治験・臨床研究支援センター概要
センター長挨拶
治験・臨床研究支援センターは、高度な医療の推進および治験・製造販売後臨床試験の適正かつ円滑な実施を支援するために、2012年に設立されました。
出口戦略を見据えた臨床研究支援体制構築のため、専門人材の確保・教育、研究者リテラシーの向上等に努め、本学オリジナルシーズを用いた臨床研究を実現してまいります。
当センターは、橋渡し研究シーズ探索センターからのシーズをはじめ、橋渡し研究支援プロセスに登録されたシーズのすべてをパイプラインとして管理し、個々のプロジェクトに対する支援の最適化提案を行い実施してまいります。
出口戦略を見据えた臨床研究支援体制構築のため、専門人材の確保・教育、研究者リテラシーの向上等に努め、本学オリジナルシーズを用いた臨床研究を実現してまいります。
当センターは、橋渡し研究シーズ探索センターからのシーズをはじめ、橋渡し研究支援プロセスに登録されたシーズのすべてをパイプラインとして管理し、個々のプロジェクトに対する支援の最適化提案を行い実施してまいります。

治験・臨床研究支援センターについて
藤田医科大学では、多くの患者さんにご協力いただき、様々な治験 ・臨床研究を行っています。
治験・臨床研究支援センターでは、製薬企業等が実施する治験だけでなく、医師自らが計画し実施する医師主導治験、アカデミアで生み出された研究シーズを実臨床へ橋渡しし、次世代に向けた新たな医療の実用化を支援する役割も担っています。
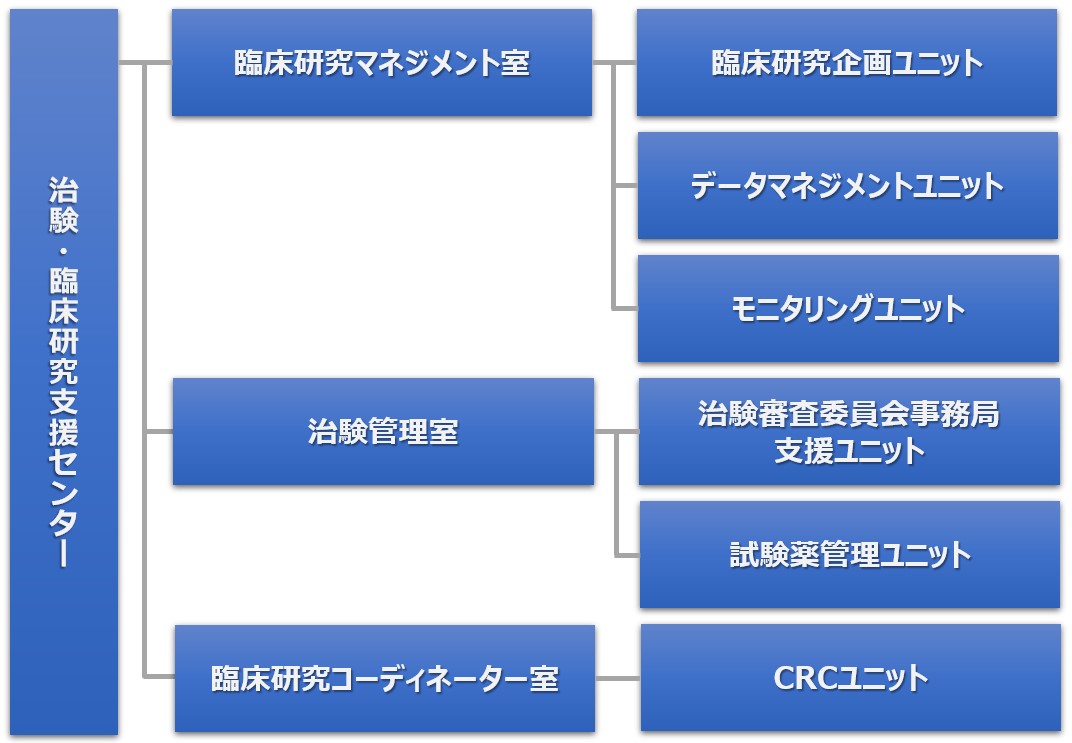
近年、治験・臨床研究を取り巻く環境は大きく変化しています。治験・臨床研究の国際化、迅速化、高品質化が求められており、当センターにおいてもこれらの課題に対応するため、治験・臨床研究支援の機能を拡大させてきました。2022年4月には、 治験・臨床研究支援センターの発展的改組を行い、治験・臨床研究の計画やマネジメント・品質管理を担う「臨床研究マネジメント室」、IRB(※)に関する事務局業務や試験薬管理を担う「治験管理室」、治験・臨床研究の実施を支援する臨床研究コーディネーター(CRC)業務や、製薬企業等の実施調査を支援する渉外業務を担う「臨床研究コーディネーター室」を設置し、GCPをはじめとする各種規制要件を遵守した倫理性・科学性及び医学的妥当性を確保した質の高い治験・臨床研究を推進しています。
治験・臨床研究支援センターでは、製薬企業等が実施する治験だけでなく、医師自らが計画し実施する医師主導治験、アカデミアで生み出された研究シーズを実臨床へ橋渡しし、次世代に向けた新たな医療の実用化を支援する役割も担っています。
近年、治験・臨床研究を取り巻く環境は大きく変化しています。治験・臨床研究の国際化、迅速化、高品質化が求められており、当センターにおいてもこれらの課題に対応するため、治験・臨床研究支援の機能を拡大させてきました。2022年4月には、 治験・臨床研究支援センターの発展的改組を行い、治験・臨床研究の計画やマネジメント・品質管理を担う「臨床研究マネジメント室」、IRB(※)に関する事務局業務や試験薬管理を担う「治験管理室」、治験・臨床研究の実施を支援する臨床研究コーディネーター(CRC)業務や、製薬企業等の実施調査を支援する渉外業務を担う「臨床研究コーディネーター室」を設置し、GCPをはじめとする各種規制要件を遵守した倫理性・科学性及び医学的妥当性を確保した質の高い治験・臨床研究を推進しています。
※ 藤田医科大学病院群共同治験審査委員会(IRB)
治験の内容が、倫理的、科学的および医学的妥当性の観点から問題がないかを審議する委員会。審査委員は、医学・薬学・その他の医療に関する専門家、専門家以外の人、病院および病院長と利害関係のない人で構成されています。
治験の内容が、倫理的、科学的および医学的妥当性の観点から問題がないかを審議する委員会。審査委員は、医学・薬学・その他の医療に関する専門家、専門家以外の人、病院および病院長と利害関係のない人で構成されています。