“気分の波”に同期して脳で時計遺伝子の発現量が周期的に変動することを発見— 双極性障害(躁うつ病)の脳内メカニズムの解明に前進 —
システム医科学研究部門の研究成果が国際誌 (Cell Reports) に掲載されました。
ポイント
- 双極性障害(躁うつ病)では起伏の激しい気分の波とそれに伴う活動量の増減が繰り返し生じる。しかし、その脳内分子メカニズムはほとんどわかっていない。
- 10〜20日程の周期で活動量が顕著に変化する“気分の波”様の行動異常を示す双極性障害モデルマウスにおいて、海馬の遺伝子発現量を網羅的に解析。その発現パターンから過去の活動量を高い精度で推定することに成功。
- “気分の波”に同期して海馬で多くの時計遺伝子の発現量が長期的な周期で変動することを発見。
- 双極性障害の脳内分子メカニズムの解明や新規治療法の開発に期待。
研究の背景と経緯
藤田保健衛生大学 総合医科学研究所の宮川剛教授らの研究室ではこれまでに180系統以上の遺伝子改変マウスに対して網羅的行動解析注3)を行うことによって、双極性障害や統合失調症をはじめとする精神疾患の症状に類似した行動異常を示すマウス系統を多数見出してきました。その中でαCaMKIIという遺伝子をヘテロで欠損したマウス注4)が、10〜20日程度の周期で活動量の増減を繰り返すこと、つまり、“気分の波”を反映するかのような行動異常を示すことを見出しました (文献1, 2)。双極性障害の患者において、このαCaMKII遺伝子の変異が健常者に比べて高い頻度で見られること (文献3)、脳内でこの遺伝子の発現量が低下していること (文献4) が知られています 。また宮川らは、αCaMKIIヘテロ欠損マウスの脳では、神経細胞が興奮しやすいという電気生理学的特徴が見られることや、成体であるにもかかわらず海馬の歯状回という脳領域の神経細胞が未成熟な状態にある「未成熟歯状回注5)」が見られることを報告してきましたが、これらに類似した現象が双極性障害患者の脳において生じていることが示唆されています (文献5, 6)。これらの知見は、αCaMKIIヘテロ欠損マウスが双極性障害の動物モデルとして高い妥当性を持つことを示しています。
研究成果の内容
以下、研究成果の詳細を解説します。
1. 脳の遺伝子発現データから過去の活動量を高い精度で推定
αCaMKIIヘテロ欠損マウスと正常マウスの活動量(ケージ内での移動距離)を2ヶ月以上にわたって測定しました。正常マウスは毎日ほぼ一定した活動を示しますが、αCaMKIIヘテロ欠損マウスでは10〜20日周期で激しく活動する時期と比較的活動しない時期が交互に繰り返し現れます(図1A, B)。活動量が高い時期には不安様の行動注7)とうつ様の行動注8)が低く、逆に活動量が低い時期には不安様の行動とうつ様の行動が高いことから(図1C, D)、このマウスが示す活動量の高低の繰り返しは“気分の波”を反映していると考えられます。
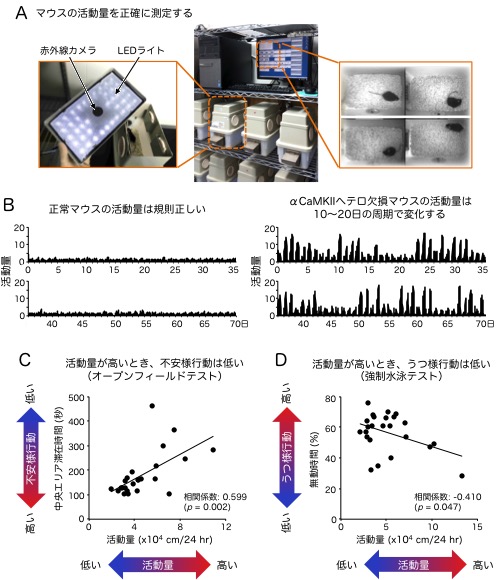
図1. αCaMKIIヘテロ欠損は“気分の波”のような行動異常を示す
(A) マウスの活動量を測定するシステム。ケージのふたに付いている赤外線カメラで撮影した画像をコンピュータで自動解析してマウスの移動距離を正確に測定します。(B) αCaMKIIヘテロ欠損マウスの活動量は、正常マウスに比べて高く、かつ、10〜20日の長期的な周期を示します。(C, D) 活動量を測定した後、オープンフィールドテストと強制水泳テストを行い、不安様の行動注7)とうつ様の行動注8)を調べました。(C) 活動量の高い時期のαCaMKIIヘテロ欠損マウスはオープンフィールド装置の中央エリアでの滞在時間が長く、不安様行動が低い一方で、活動量の低い時期は中央エリアでの滞在時間が短く、不安様行動が高い傾向にあります。(D) 活動量の高い時期のαCaMKIIヘテロ欠損マウスは強制水泳テストでの無動時間が短く、うつ様行動が低い一方で、活動量の低い時期は無動時間が長く、うつ様行動が高い傾向にあります。
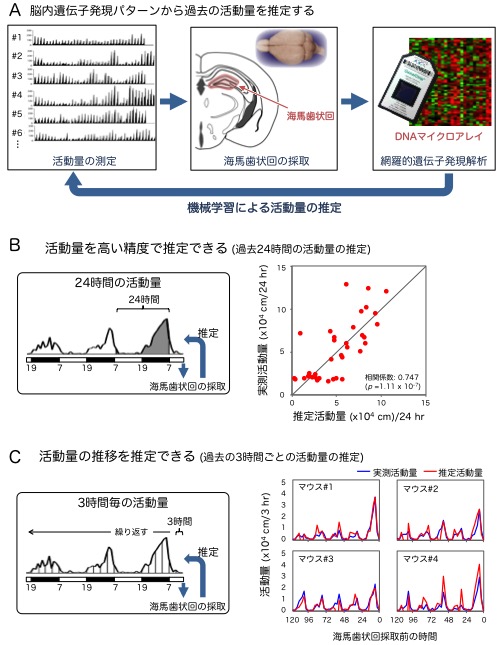
図2. 脳内遺伝子発現パターンから活動量を推定することに成功
(A) 活動量を測定後、海馬歯状回を採取し、遺伝子発現量の網羅的解析を行いました。得られた遺伝子発現データをもとに機械学習によるモデル式作成し、過去の活動量を推定しました。本研究では、1匹を除いた36匹分の活動量と遺伝子発現のデータから学習してそれらの間にある規則性を見つけ、その規則性に従って残り1匹の遺伝子発現データからそのマウスの活動量を推定しました。この手順を繰り返して37匹分の活動量の推定値を得ました。(B) モデル式から算出された過去24時間の活動量の推定値は、実際の測定値と有意な相関を示しました(赤点は37匹のαCaMKIIへテロ欠損マウスの活動量の推定値と実測値が交差した位置を示す)。つまり、海馬歯状回の遺伝子発現パターンから過去24時間の活動量を高い精度で推定できることが明らかになりました。(C) 過去の3時間ごとの活動量の推定モデルを作成し、5日間分繰り返しました。37匹のうちの4匹のデータを示します。活動量の推定値(赤線)と実測値(青線)がほぼ重なっていることから、過去数日間の活動量の推移を推定できることがわかりました。
3万以上の膨大な数の遺伝子の中から活動量を推定するために選ばれた遺伝子 (群) は、その活動量の特徴をよく表現する遺伝子であると考えられます。そこで、どのような特徴を持つ遺伝子が選ばれたのかを調べたところ、時計遺伝子と呼ばれる遺伝子が多く選ばれていることを発見しました (図3A)。時計遺伝子は概日リズムを司る遺伝子群の総称で、その多くは約24時間周期の発現変化を示します。今回、時計遺伝子の中には、“気分の波”と同期するかのように10〜20日の長期的な周期で発現量が変化するものがたくさんあることを突き止めました。ヒト死後脳の解析から、健常者と比べて双極性障害の患者の脳でいくつかの時計遺伝子の発現量が変化していることはこれまでに知られていますが、活動量の変化に合わせて脳内で多くの時計遺伝子の発現量が長期的な周期で変化するという今回の発見は全く新しいものです。
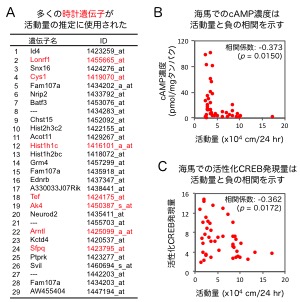
(A) 過去24時間の活動量の推定に使われた遺伝子のリスト。活動量を高い精度で推定するのに使用された遺伝子の中に時計遺伝子(赤字)が多く含まれていることを発見しました。また、活動量の高い時期は海馬歯状回でのcAMPの濃度 (B)および活性化CREBの量 (C)が低く、活動量の低い時期は逆に高く、負の相関関係にあることがわかりました。
次に、どのような分子がこの時計遺伝子の長期的周期の発現を調節しているのかを調べるため、活動量と関連する海馬歯状回での分子発現をさらに解析しました。その結果、細胞内のシグナル伝達を担う「環状AMP (cAMP)/CREB経路」に関わる分子群の発現量が活動量と相関することを見つけました (図3B, C)。さらに、双極性障害の治療にも使われている気分安定薬でこのマウスの活動量を人為的に増加あるいは減少させたとき (図4)、その活動量の変化に対応して海馬での活性化CREBの量も変化していることがわかりました。これらのことから、CREBを介する細胞内シグナル伝達経路が活動量の変化と強い関連を持っていると考えられました。cAMP/CREB経路は、いくつかの時計遺伝子の24時間周期の発現を調節する因子として知られていますが、今回、時計遺伝子の長期的な周期の発現を調節する役割も持っていることが示唆されました。
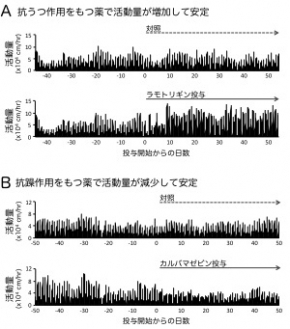
このマウスの活動量は、ヒトの双極性障害の治療で使われている気分安定薬に反応して安定することが明らかとなりました。(A) 抗うつ効果をもつラモトリギンを投与すると、投与前に比べて活動量は増加し安定しました。(B) 一方、抗躁効果を持つカルバマゼピンの投与で活動量は減少し安定しました。グラフでは、各処置グループ9〜11匹のマウスの活動量の平均した値を示しています。
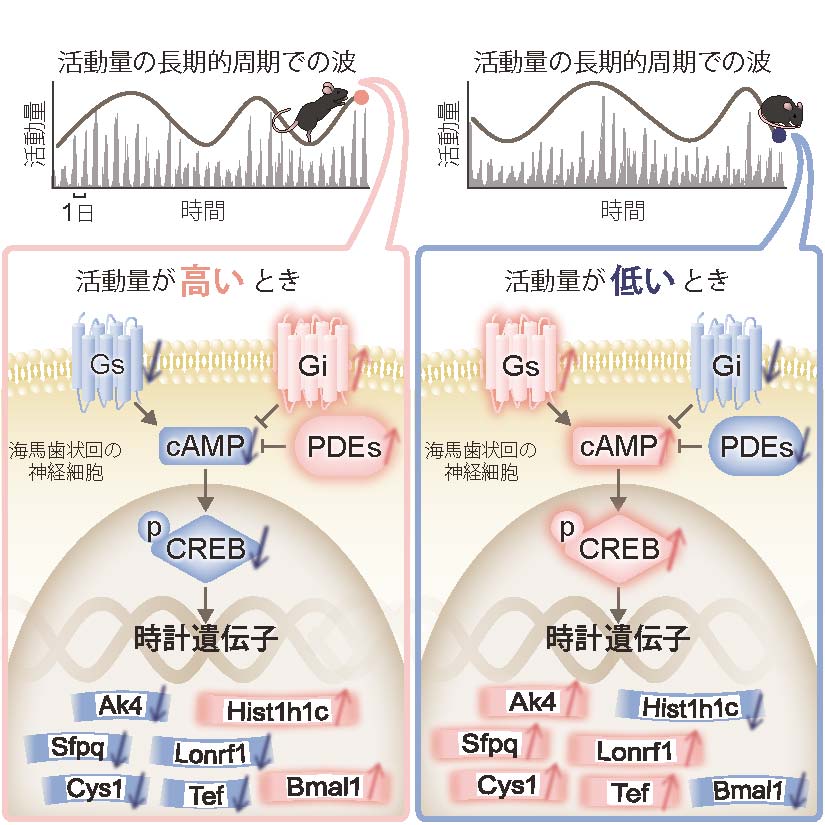
本研究では、気分の調節に重要な役割を持つ海馬歯状回において、時計遺伝子の発現量が活動量と同期して長期的な周期で変動することを発見しました。さらに、その調節機構のひとつとしてcAMP/CREB経路が見出されました。赤色の上向き矢印は増加を、青色の下向き矢印は減少を示します。これらの分子変化は、“気分の波”の脳内分子基盤の一部であると考えられます。
今後の展開
参考文献
Yamasaki, N., Maekawa, M., Kobayashi, K., Kajii, Y., Maeda, J., Soma, M., Takao, K., Tanda, K., Ohira, K., Toyama, K., et al. (2008). Alpha-CaMKII deficiency causes immature dentate gyrus, a novel candidate endophenotype of psychiatric disorders. Mol. Brain 1, 6.
文献2
Hagihara, H., Takao, K., Walton, N.M., Matsumoto, M., and Miyakawa, T. (2013). Immature dentate gyrus: an endophenotype of neuropsychiatric disorders. Neural Plast. 2013.
文献3
Ament, S.A., Szelinger, S., Glusman, G., Ashworth, J., Hou, L., Akula, N., Shekhtman, T., Badner, J.A., Brunkow, M.E., Mauldin, D.E., et al. (2015). Rare variants in neuronal excitability genes influence risk for bipolar disorder. Proc. Natl. Acad. Sci. 112, 3576–3581.
文献4
Xing, G., Russell, S., Hough, C., O’Grady, J., Zhang, L., Yang, S., Zhang, L.-X., and Post, R. (2002). Decreased prefrontal CaMKII alpha mRNA in bipolar illness. Neuroreport 13, 501–505.
文献5
Mertens, J., Wang, Q.-W., Kim, Y., Yu, D.X., Pham, S., Yang, B., Zheng, Y., Diffenderfer, K.E., Zhang, J., Soltani, S., et al. (2015). Differential responses to lithium in hyperexcitable neurons from patients with bipolar disorder. Nature 527, 95–99.
文献6
Walton, N.M., Zhou, Y., Kogan, J.H., Shin, R., Webster, M., Gross, A.K., Heusner, C.L., Chen, Q., Miyake, S., Tajinda, K., et al. (2012). Detection of an immature dentate gyrus feature in human schizophrenia/bipolar patients. Transl. Psychiatry 2, e135.
用語説明
約24時間周期で発現量が変動する遺伝子(群)の総称。概日リズムや体内時計の調節に関与している。
注2) 双極性障害
躁状態とうつ状態の二つの病相が周期的に交代して現れる精神疾患。日本人の生涯有病率は0.7%程度とされている。
注3) 網羅的行動解析
遺伝子改変マウスの感覚、運動、情動、睡眠・リズム、注意、学習・記憶、社会的行動などさまざまな行動領域を解析するために用いられている行動テストを組み合わせたもの。効率の良い網羅的な解析を可能としている。
注4) ヘテロ欠損マウス
ヒトを含め有性生殖を行う生物の多くは、両親からそれぞれの遺伝子セットを受け取り、父母由来の計2つ遺伝子セットを持っている。ある遺伝子の片方を欠損したマウスをヘテロ欠損マウスと呼ぶ。
注5) 未成熟歯状回
歯状回は、気分や情動、記憶をつかさどる海馬の一領域で、海馬への情報入力に重要な役割を果たしている。近年、成体においても毎日数千の神経細胞が生まれてくる場所であることが明らかにされた。生まれてきた神経細胞は、刺激を受け活動することにより成長し、1~2ヵ月で「成熟神経細胞」となり海馬の回路に組み込まれる。それまでは「未成熟神経細胞」と呼ばれ、成熟した神経細胞とは形状や性質が顕著に異なることが知られている。何らかの原因で歯状回の神経細胞が未成熟な状態になっているものを「未成熟歯状回」と呼んでいる。
注6) 機械学習
既知のデータから規則性・パターンを見つけ出し、その結果に基づいて未知のデータを推定すること。機械学習の応用例として、過去の閲覧履歴からユーザーの需要を推定するオンラインショップのレコメンド機能や、過去に迷惑メールとされたもののパターンを学習する迷惑メール判定などがある。
注7) 不安様行動
マウスは、新奇で広く明るい箱(オープンフィールド)の中に入れられると、箱の隅の辺りを動き回るかあるいは身動きしなくなり、明るく開けた中央エリア付近にはあまり近寄らない。しかし、積極的に中央エリア付近を探索するマウスは不安傾向が低いと考えられる。
注8) うつ様行動
強制水泳テストにおいて、マウスは水に入れた直後は脱出しようと動き回るが、次第に遊泳しなくなり無動時間が増える。無動時間が長ければうつ様行動の増加と解釈される。
注9) DNAマイクロアレイ
ガラスや半導体の基板の上にDNAを貼り付けたもので、脳組織や血液などから抽出した遺伝子がどの程度発現しているかを網羅的に調べることができる。
掲載論文
Circadian Gene Circuitry Predicts Hyperactive Behavior in a Mood Disorder Mouse Model. Cell Reports 14(12): 2784-2796, 2016.
