難病治療学研究部門(土田教授)の常陸助教の研究成果がEMBO Reportsに発表されました。
新規の長鎖ノンコーディングRNAを発見
神経の損傷に起因する筋萎縮の新治療法の開発に期待
神経の損傷に起因する筋萎縮の新治療法の開発に期待
発表のポイント:
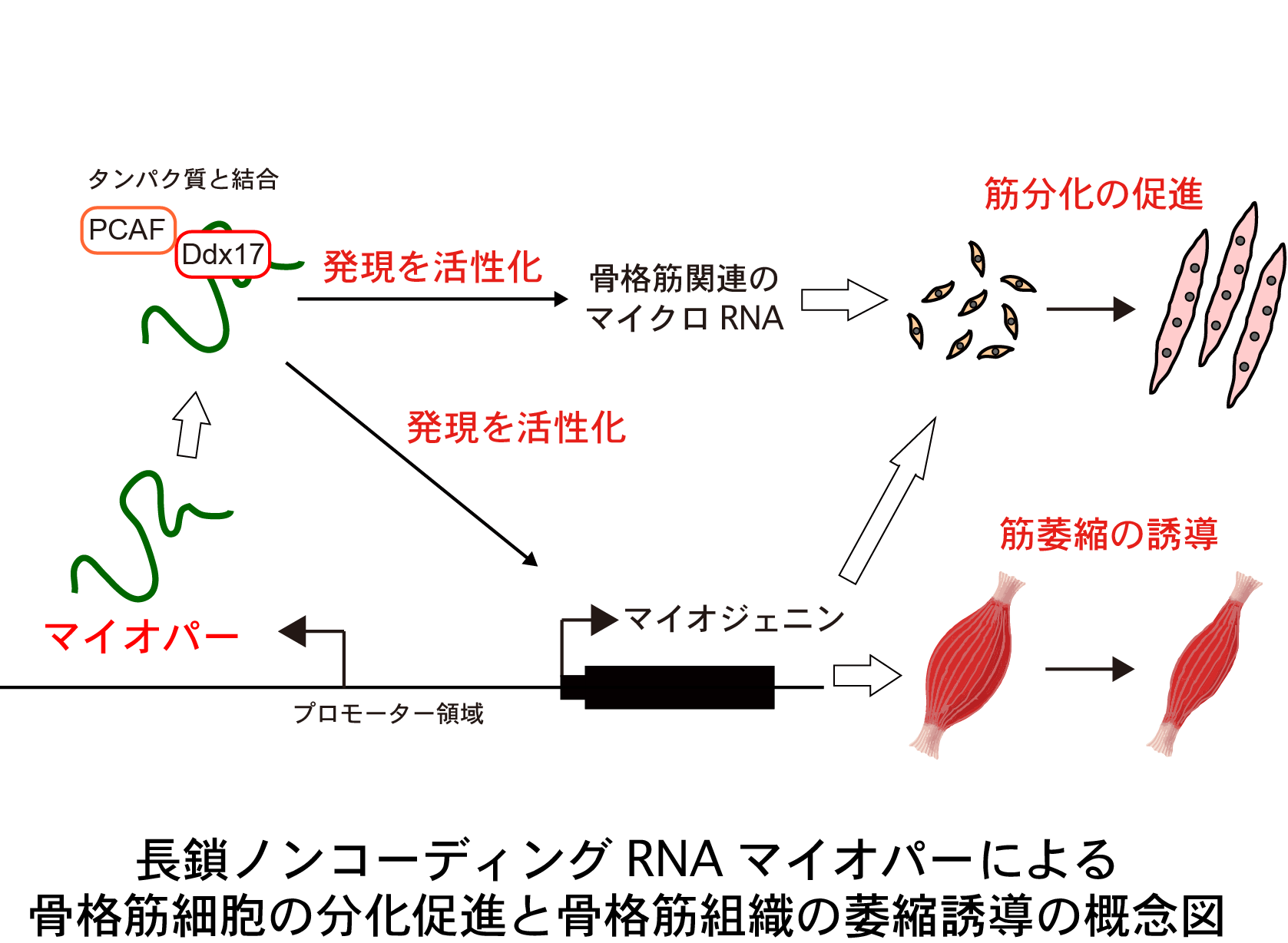
◆骨格筋の元となる細胞が、正しく骨格筋を作るために必要な新規の長鎖ノンコーディングRNA(注1)を発見し、このRNAを「マイオパー」と名付けました。
◆マイオパー(注2)が、骨格筋を作るために必要な複数の遺伝子(マイオジェニン遺伝子(注3)とマイクロRNAの遺伝子(注4))のスイッチをオンにするために必要であることを明らかにしました。
◆マイオパーの量を骨格筋組織で減らすと、神経を損傷した時に骨格筋が萎縮する症状(注5)をマウスで緩和することに成功しました。
◆マイオパーの阻害は、神経の損傷によって引き起こされるヒトの筋萎縮に対しての新たな核酸医薬の開発につながると期待されます。
◆骨格筋の元となる細胞が、正しく骨格筋を作るために必要な新規の長鎖ノンコーディングRNA(注1)を発見し、このRNAを「マイオパー」と名付けました。
◆マイオパー(注2)が、骨格筋を作るために必要な複数の遺伝子(マイオジェニン遺伝子(注3)とマイクロRNAの遺伝子(注4))のスイッチをオンにするために必要であることを明らかにしました。
◆マイオパーの量を骨格筋組織で減らすと、神経を損傷した時に骨格筋が萎縮する症状(注5)をマウスで緩和することに成功しました。
◆マイオパーの阻害は、神経の損傷によって引き起こされるヒトの筋萎縮に対しての新たな核酸医薬の開発につながると期待されます。
発表概要
骨格筋細胞の正常な分化とある種の骨格筋の萎縮には、マイオジェニン遺伝子の発現が活性化することが必要です。藤田医科大学総合医科学研究所の土田邦博教授と常陸圭介助教らの研究グループは、マイオジェニン遺伝子のプロモーターと呼ばれDNAの制御領域から、タンパク質をコードしない新規の長鎖ノンコーディングRNAを発見しました。研究グループは、このRNAを「マイオパー」(英語表記: Myoparr)と名付け、マイオパーがマイオジェニン遺伝子の発現の活性化を通じて、骨格筋細胞の正常な分化と、神経の損傷に起因する骨格筋組織の萎縮を促進していることを突き止めました。この発見は、骨格筋細胞の分化という我々の体を形成する基本的な生命現象に関わる長鎖ノンコーディングRNAが、筋萎縮という病的な場面においても機能していることを示しています。そのため、遺伝子の発現が活性化される仕組みの理解だけでなく、ノンコーディングRNAを標的とした診断・創薬へと研究を発展させる上でも重要な知見になることが期待されます。
発表内容
骨格筋は我々の体の30-40%を占める人体で最も大きな臓器です。筋芽細胞と呼ばれる単核の細胞が増殖後に、筋管と呼ばれる多核の細胞へと分化・成熟することで骨格筋は形成されます。この過程は筋分化と呼ばれ、細胞分化のモデル系として古くから研究が行われてきました。筋分化が正常に進むためには、マイオジェニン遺伝子の発現が活性化することが必要です。マイオジェニン遺伝子の発現を活性化するために必要なDNAの制御領域は、1993年に発見されています。しかしながら、このDNA領域がマイオジェニン遺伝子の発現を活性化する仕組みについてはこれまで不明でした。近年、細胞内にはタンパク質をコードしないノンコーディングRNAが非常に多く存在することがわかってきています。ノンコーディングRNAの中でも200塩基以上のサイズの長鎖ノンコーディングRNAの多くは、遺伝子と遺伝子の間に存在するシス調節領域(注6)から発現することが明らかとなっています。これらのノンコーディングRNAは、近くの遺伝子の発現の活性化や抑制に関わっていると考えられていますが、細胞分化や疾患における役割は未だよくわかっていません。
研究グループは、マウスとヒトの骨格筋細胞を用いてPCR法(ポリメラーゼ連鎖反応)による解析を行い、マイオジェニン遺伝子の発現の活性化に必要なDNA領域から長鎖ノンコーディングRNAが発現していることを発見し、このRNAを「マイオパー」と名付けました。また、マイオパーの発現をRNAiという手法で抑制した場合に、マイオジェニン遺伝子の発現が活性化されなくなり、マウス骨格筋株化細胞の筋分化が停止することがわかりました。RNA-seqと呼ばれる網羅的な遺伝子発現の解析手法を利用することで、マイオパーがマイオジェニン遺伝子の発現の制御とは別に、骨格筋関連の複数のマイクロRNAの発現も活性化していることがわかりました。さらに分子的な仕組みとしては、マイオパーが転写活性化補因子Ddx17とヒストンアセチル基転移酵素PCAFの相互作用に必要であることを見出しました。マイオジェニン遺伝子の発現は、骨格筋を支配する神経の損傷によっても活性化し、筋萎縮の引き金となることが知られています。研究グループは、マイオパーの発現が筋萎縮時に増加することを見出し、マイオパーの発現をRNAiにより抑制することで、マウス骨格筋組織におけるマイオジェニン遺伝子の発現の活性化を抑え、筋萎縮を緩和することに成功しました。
本研究から、マイオパーがマイオジェニン遺伝子の発現の活性化を通じて、骨格筋細胞の正常な分化と、神経の損傷に起因する骨格筋組織の萎縮を促進する新たな因子であることが明らかとなりました。マイオパーは遠位に存在する複数のマイクロRNAの発現の活性化にも必要であることから、DNAの制御領域から発現する長鎖ノンコーディングRNAの機能は、従来考えられていた近傍の遺伝子発現を制御するという機能に加えて、より複雑で巧妙な仕組みであると考えられます。今回の成果は遺伝子の発現が活性化される仕組みを理解する上で重要な知見になることが期待されます。マイオジェニン遺伝子の発現は、筋萎縮性側索硬化症、ハンチントン病、脊髄性筋萎縮症においても活性化することが報告されており、今回の研究成果は、将来的にそれらの疾患によって生じる筋萎縮の治療にも応用できる可能性があります。マイオパーはマウスだけでなくヒトでも存在していますが、今後はヒトのマイオパーがヒトのマイオジェニン遺伝子の発現の活性化にも必要であることの確認と、さらにマイオパーの発現阻害の安全性について確認することが必要です。
本研究成果は、日本学術振興会科学研究費補助金 基盤研究(C)(常陸圭介、土田邦博)、精神・神経疾患研究開発費(土田邦博)、公益財団法人中冨健康科学振興財団 研究助成(常陸圭介)の支援によって行われました。
研究グループは、マウスとヒトの骨格筋細胞を用いてPCR法(ポリメラーゼ連鎖反応)による解析を行い、マイオジェニン遺伝子の発現の活性化に必要なDNA領域から長鎖ノンコーディングRNAが発現していることを発見し、このRNAを「マイオパー」と名付けました。また、マイオパーの発現をRNAiという手法で抑制した場合に、マイオジェニン遺伝子の発現が活性化されなくなり、マウス骨格筋株化細胞の筋分化が停止することがわかりました。RNA-seqと呼ばれる網羅的な遺伝子発現の解析手法を利用することで、マイオパーがマイオジェニン遺伝子の発現の制御とは別に、骨格筋関連の複数のマイクロRNAの発現も活性化していることがわかりました。さらに分子的な仕組みとしては、マイオパーが転写活性化補因子Ddx17とヒストンアセチル基転移酵素PCAFの相互作用に必要であることを見出しました。マイオジェニン遺伝子の発現は、骨格筋を支配する神経の損傷によっても活性化し、筋萎縮の引き金となることが知られています。研究グループは、マイオパーの発現が筋萎縮時に増加することを見出し、マイオパーの発現をRNAiにより抑制することで、マウス骨格筋組織におけるマイオジェニン遺伝子の発現の活性化を抑え、筋萎縮を緩和することに成功しました。
本研究から、マイオパーがマイオジェニン遺伝子の発現の活性化を通じて、骨格筋細胞の正常な分化と、神経の損傷に起因する骨格筋組織の萎縮を促進する新たな因子であることが明らかとなりました。マイオパーは遠位に存在する複数のマイクロRNAの発現の活性化にも必要であることから、DNAの制御領域から発現する長鎖ノンコーディングRNAの機能は、従来考えられていた近傍の遺伝子発現を制御するという機能に加えて、より複雑で巧妙な仕組みであると考えられます。今回の成果は遺伝子の発現が活性化される仕組みを理解する上で重要な知見になることが期待されます。マイオジェニン遺伝子の発現は、筋萎縮性側索硬化症、ハンチントン病、脊髄性筋萎縮症においても活性化することが報告されており、今回の研究成果は、将来的にそれらの疾患によって生じる筋萎縮の治療にも応用できる可能性があります。マイオパーはマウスだけでなくヒトでも存在していますが、今後はヒトのマイオパーがヒトのマイオジェニン遺伝子の発現の活性化にも必要であることの確認と、さらにマイオパーの発現阻害の安全性について確認することが必要です。
本研究成果は、日本学術振興会科学研究費補助金 基盤研究(C)(常陸圭介、土田邦博)、精神・神経疾患研究開発費(土田邦博)、公益財団法人中冨健康科学振興財団 研究助成(常陸圭介)の支援によって行われました。
発表雑誌
雑誌名:「EMBO Reports」(1月8日オンライン版)
論文タイトル: Myogenin promoter-associated lncRNA Myoparr is essential for myogenic differentiation
著者:常陸 圭介、中谷 直史、高崎 昭彦、大内 雄矢、上住 聡芳、上田 洋司、稲垣 秀人、倉橋 浩樹、土田 邦博
DOI番号: 10.15252/embr.201847468
http://embor.embopress.org/content/early/2019/01/03/embr.201847468
論文タイトル: Myogenin promoter-associated lncRNA Myoparr is essential for myogenic differentiation
著者:常陸 圭介、中谷 直史、高崎 昭彦、大内 雄矢、上住 聡芳、上田 洋司、稲垣 秀人、倉橋 浩樹、土田 邦博
DOI番号: 10.15252/embr.201847468
http://embor.embopress.org/content/early/2019/01/03/embr.201847468
用語解説
(注1) 長鎖ノンコーディングRNA
タンパク質をコードしないノンコーディングRNAのうち、約200塩基以上のものを指す。タンパク質に翻訳されず、RNA分子自体が機能を有する。
(注2) マイオパー
マイオジェニン遺伝子のプロモーター領域に関連した筋分化を制御する長鎖ノンコーディングRNAという意味で発表者がマイオパーと命名した。
(注3) マイオジェニン遺伝子
bHLH型の転写因子をコードし、脊椎動物間で広く保存されている遺伝子。マイオジェニンタンパク質により骨格筋を形成する様々な遺伝子の発現がONになるため、正常な筋分化に必要。筋分化以外の機能として、神経原性の筋萎縮を引き起こす因子であることが2010年に報告された。
(注4) マイクロRNA
タンパク質をコードしないノンコーディングRNAのうち、20-25塩基の小サイズのものを指す。標的とする遺伝子のメッセンジャーRNAの分解やタンパク質の翻訳を阻害することで遺伝子の発現を制御する。
(注5) 骨格筋の萎縮
骨格筋は、姿勢を保ち身体を動かすためだけではなく、全身の代謝調節にも必要な器官である。疾患による筋萎縮だけでなく、老化による筋萎縮(サルコペニア)が近年深刻な健康問題となっている。
(注6) シス調節領域
遺伝子の遠位に存在するエンハンサーや、遺伝子の近位に存在するプロモーターと呼ばれるDNA上の遺伝子の発現を制御する領域。
タンパク質をコードしないノンコーディングRNAのうち、約200塩基以上のものを指す。タンパク質に翻訳されず、RNA分子自体が機能を有する。
(注2) マイオパー
マイオジェニン遺伝子のプロモーター領域に関連した筋分化を制御する長鎖ノンコーディングRNAという意味で発表者がマイオパーと命名した。
(注3) マイオジェニン遺伝子
bHLH型の転写因子をコードし、脊椎動物間で広く保存されている遺伝子。マイオジェニンタンパク質により骨格筋を形成する様々な遺伝子の発現がONになるため、正常な筋分化に必要。筋分化以外の機能として、神経原性の筋萎縮を引き起こす因子であることが2010年に報告された。
(注4) マイクロRNA
タンパク質をコードしないノンコーディングRNAのうち、20-25塩基の小サイズのものを指す。標的とする遺伝子のメッセンジャーRNAの分解やタンパク質の翻訳を阻害することで遺伝子の発現を制御する。
(注5) 骨格筋の萎縮
骨格筋は、姿勢を保ち身体を動かすためだけではなく、全身の代謝調節にも必要な器官である。疾患による筋萎縮だけでなく、老化による筋萎縮(サルコペニア)が近年深刻な健康問題となっている。
(注6) シス調節領域
遺伝子の遠位に存在するエンハンサーや、遺伝子の近位に存在するプロモーターと呼ばれるDNA上の遺伝子の発現を制御する領域。
問い合わせ先
<研究内容に関すること>
・土田 邦博(つちだ くにひろ)
藤田医科大学 総合医科学研究所
難病治療学研究部門 教授
〒470-1192
愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel: 0562-93-9384
Email: tsuchida@fujita-hu.ac.jp
<報道・プレスリリースついて>
・藤田医科大学 広報部 学園広報課
〒470-1192
愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel: 0562-93-2492
E-mail: koho-pr@fujita-hu.ac.jp
・土田 邦博(つちだ くにひろ)
藤田医科大学 総合医科学研究所
難病治療学研究部門 教授
〒470-1192
愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel: 0562-93-9384
Email: tsuchida@fujita-hu.ac.jp
<報道・プレスリリースついて>
・藤田医科大学 広報部 学園広報課
〒470-1192
愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel: 0562-93-2492
E-mail: koho-pr@fujita-hu.ac.jp
