萩原講師らの研究成果が『Neuropsychopharmacology』に掲載されました。
統合失調症や双極性障害などの精神疾患において
脳は酸性に傾いている
宮川剛教授、萩原英雄講師らは、統合失調症や双極性障害、自閉症など複数の精神疾患モデルマウスにおいて、脳のpH(ピーエイチ、あるいはペーハー)が低下している、つまり脳が酸性に傾いていることを世界で初めて明らかにしました。脳のpH低下は、ヒト精神疾患の死後脳サンプルを解析した10の研究を統合した統計解析でも確認されたことから、精神疾患の脳内病態のひとつであると考えられます。本研究成果は日豪米9機関の共同研究により得られ、2017年8月4日(米国東部時間)に米国神経精神薬理学会誌「Neuropsychopharmacology」のオンライン版で公開されました。
ポイント
- 統合失調症や双極性障害などの精神疾患罹患者において、脳のpHが低下していること、つまり酸性に傾いていることは、抗精神病薬の摂取など疾患そのものではない二次的な要因(混交要因)の影響であると考えられてきた。
- 本研究において、ヒト精神疾患の10の研究データを統合した統計解析を行い、混交要因となり得るいくつかの要因を考慮した場合も罹患者の脳のpH低下を確認。
- 精神疾患モデルマウスを活用し、各種の混交要因候補を制御した状態で脳のpHを測定。調べた5種類のモデルマウスのいずれにおいても脳のpHが低下していることを発見。
- これまでの定説とは異なり、脳のpH低下は精神疾患の疾患そのものに由来する変化である可能性が高いことが示された。本知見に基づいた病態研究の新展開が期待される。
研究の背景と経緯
体内の酸性/アルカリ性のバランス、つまりpH(ピーエイチ、あるいはペーハー)注1)の適切な維持は健康に重要だと考えられています。とくに各種組織・臓器におけるpHの低下(酸性に傾くこと)は、心機能の低下や呼吸障害、腎障害など様々な病的状態と関係していると考えられています。では、精神疾患に関してはどうなのでしょうか。

図1. 精神疾患罹患者の脳pH低下に関するこれまでの定説と、本研究から得られた新しい知見
これまで、死後脳組織を用いた研究において、統合失調症 注2)や双極性障害 注3)、自閉症 注4)の罹患者では健常者に比べて脳のpHが低いという報告はなされています。しかしこの脳のpH低下は、精神疾患の疾患そのものに由来する変化(病態)を反映した現象というよりはむしろ、疾患そのものではない二次的な要因(混交要因)から生じた現象であると主に考えられてきました(図1)。例えば、抗精神病薬の投与によって脳内の乳酸濃度が増加することでpHが低下する、ということがラットを用いた研究で示唆されています(文献1)。また、死亡時の状況(亡くなる直前の状態;死戦期 注5))が脳のpHに影響することが知られています(文献2)。さらに、死亡時の年齢や、死後経過時間(死亡した時点から脳が摘出され、凍結保存されるまでの時間)なども死後脳の状態に影響する要因として考えられています。ヒト死後脳組織を用いた研究においてはこれらの要因を制御することは困難です。しかし、モデル動物を活用すれば、このような混交要因となり得る各種要因を厳密に制御した状態で検証することができます。本研究では、統合失調症や双極性障害、自閉症などの精神疾患の複数のモデルマウスの脳を解析し、pHの低下が見られるかどうか検討を行いました。
研究成果の内容
まず初めに、統合失調症と双極性障害の罹患者の脳のpHについて、過去の研究データを統合した統計解析を行い、いずれの疾患においても健常者と比べてpHが低くなっていることを確認しました。その次に、5種類の精神疾患モデルマウスの脳の解析を行い、調べたすべてのモデルマウスにおいて、正常マウスに比べてpHの低下と乳酸濃度の増加を見出しました。
以下、研究成果の詳細を解説します。
以下、研究成果の詳細を解説します。
1. 精神疾患患者における脳のpHの低下
統合失調症および双極性障害罹患者の死後脳組織のpHに関するデータを、公共データベースから網羅的に検索し、10種類のデータセットを入手しました。これらのデータセットについて、分散分析(診断とデータセットを要因とした二元配置分散分析)による統計解析を行った結果、健常者に比べて統合失調症および双極性障害罹患者の脳のpHが有意に低いことがわかりました(統合失調症 P < 1.0 x 10-7、双極性障害 P = 9.6 x 10-6;図2)。
統合失調症および双極性障害罹患者の死後脳組織のpHに関するデータを、公共データベースから網羅的に検索し、10種類のデータセットを入手しました。これらのデータセットについて、分散分析(診断とデータセットを要因とした二元配置分散分析)による統計解析を行った結果、健常者に比べて統合失調症および双極性障害罹患者の脳のpHが有意に低いことがわかりました(統合失調症 P < 1.0 x 10-7、双極性障害 P = 9.6 x 10-6;図2)。
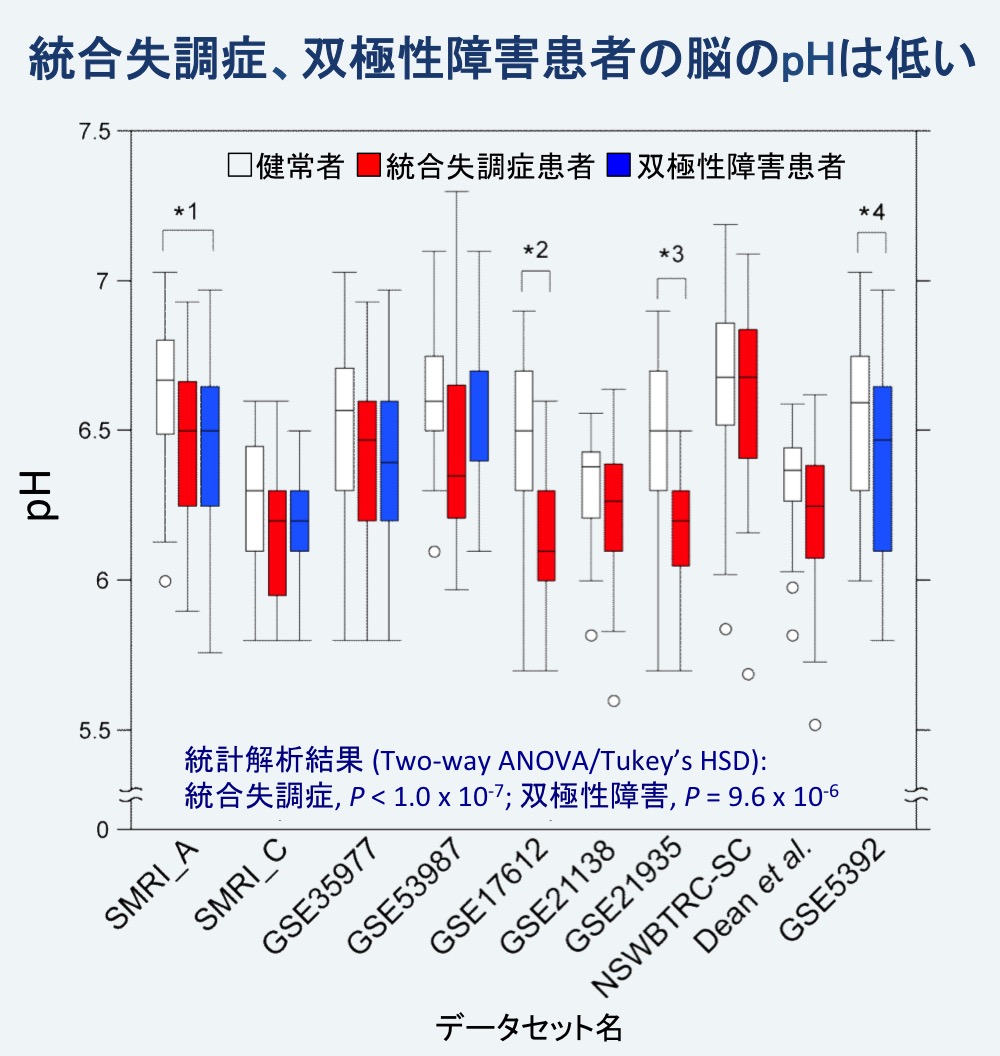
図2. 統合失調症、双極性障害の罹患者における脳pHの低下
健常者(白)、統合失調症罹患者(赤)、双極性障害罹患者(青)の死後脳pHの値を箱ヒゲ図で表した。箱の上端と下端はそれぞれ75%値と25%値を、ヒゲの上端と下端は最大値と最小値(外れ値を除く)を示す。10種類のデータセットを統合して統計解析を行った結果、いずれの疾患の患者も健常者に比べて有意に低いpHを示した。アスタリスクは個別のデータセットにおける統計的な有意差を示す(*1 P = 0.0020, *2 P < 0.0001, *3 P = 0.0001, *4 P = 0.027)。
健常者(白)、統合失調症罹患者(赤)、双極性障害罹患者(青)の死後脳pHの値を箱ヒゲ図で表した。箱の上端と下端はそれぞれ75%値と25%値を、ヒゲの上端と下端は最大値と最小値(外れ値を除く)を示す。10種類のデータセットを統合して統計解析を行った結果、いずれの疾患の患者も健常者に比べて有意に低いpHを示した。アスタリスクは個別のデータセットにおける統計的な有意差を示す(*1 P = 0.0020, *2 P < 0.0001, *3 P = 0.0001, *4 P = 0.027)。
さらに、死亡時の年齢および死後経過時間のpHへの影響を考慮した統計解析(共分散分析)においても、両疾患において健常者に比べて有意なpHの低下が認められました(統合失調症 P < 0.0001、双極性障害 P = 0.0028)。また、抗精神病薬の摂取量の情報が付随していたデータセットについて、pHと抗精神病薬摂取量の関連を調べるため相関解析を行ったところ、それらの間に有意な相関は見られませんでした。つまり、死亡時の年齢や死後経過時間、抗精神病薬の摂取は脳のpH低下に寄与する主要な要因ではないことが示唆されます。以上の結果は、これらの精神疾患罹患者における脳pHの低下は混交要因により生じた単なる二次的な現象ではなく、疾患そのものに由来する変化であるという考えを支持するものです。
2. 精神疾患モデルマウスにおける脳のpHの低下
次に、精神疾患モデルとして以下の5種類の系統の遺伝子改変マウスを用いて、脳pHの解析を行いました。
次に、精神疾患モデルとして以下の5種類の系統の遺伝子改変マウスを用いて、脳pHの解析を行いました。
統合失調症モデル:
双極性障害モデル:
自閉症モデル:
双極性障害モデル:
自閉症モデル:
Schnurri-2(シュヌリ・ツー; Shn2)遺伝子欠損マウス(文献3)
Calcineurin(カルシニューリン; Cn)遺伝子欠損マウス(文献4)
Neurogranin(ニューログラニン; Nrgn)遺伝子欠損マウス(文献5)
Camk2a(カムケーツー・アルファ)遺伝子欠損マウス(文献6,7)
Chd8(シーエイチディ・エイト)遺伝子欠損マウス(文献8)
Calcineurin(カルシニューリン; Cn)遺伝子欠損マウス(文献4)
Neurogranin(ニューログラニン; Nrgn)遺伝子欠損マウス(文献5)
Camk2a(カムケーツー・アルファ)遺伝子欠損マウス(文献6,7)
Chd8(シーエイチディ・エイト)遺伝子欠損マウス(文献8)
これらのマウスは、それぞれの疾患の発症に関連が示唆されている遺伝子の変異を持つだけでなく、罹患者と共通した脳内の分子・形態レベルでの異常や行動レベルでの異常を示すことから、それぞれの精神疾患の動物モデルとして極めて高い妥当性を持つと考えられます(図3)。
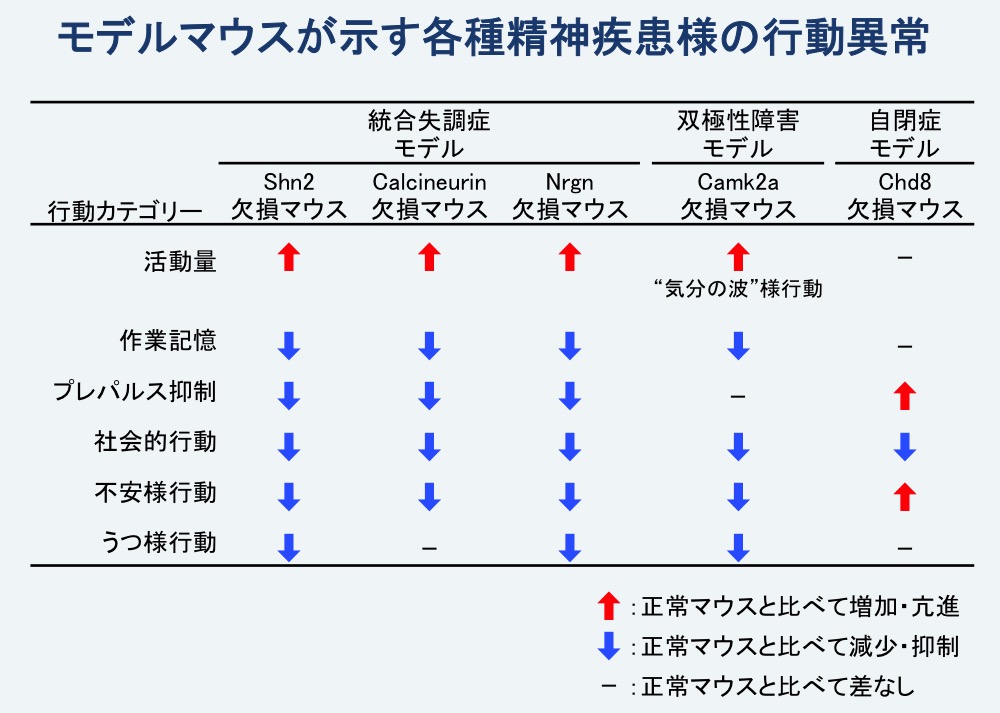
図3. 本研究で用いたモデルマウスは各種の精神疾患に関連する多くの行動異常を示す
Shn2欠損マウス、Calcineurin欠損マウス、Nrgn欠損マウスは共通して活動量の亢進、作業記憶の障害、プレパルス抑制注6)の障害などを示す。Camk2a欠損マウスは10〜20日ほどの周期で活動量が顕著に変化する“気分の波”様の行動異常を示す。Chd8欠損マウスは活動量や作業記憶は正常だが、社会的行動の低下や不安様行動の増加が見られる。
Shn2欠損マウス、Calcineurin欠損マウス、Nrgn欠損マウスは共通して活動量の亢進、作業記憶の障害、プレパルス抑制注6)の障害などを示す。Camk2a欠損マウスは10〜20日ほどの周期で活動量が顕著に変化する“気分の波”様の行動異常を示す。Chd8欠損マウスは活動量や作業記憶は正常だが、社会的行動の低下や不安様行動の増加が見られる。
いずれのマウスも薬剤の投与歴はなく、脳の摘出・凍結の方法を統一することで死戦期の状態および死後経過時間をほぼ一定に保ちました。また、それぞれの系統において、遺伝子欠損マウスと対照となる正常マウスとで週齢をそろえています。得られた脳サンプルは規定量の蒸留水中で破砕・懸濁し、pHメーターで溶液のpHを測定しました。
その結果、今回調べた5種類のモデルマウスすべてにおいて、正常マウスに比べて遺伝子改変マウスで脳のpHが有意に低下していることを発見しました(図4a)。さらに、同じ溶液を用いて乳酸濃度を測定したところ、5系統のマウスで有意に増加していることもわかりました(図4b)。すべてのマウスのデータを統合してpHと乳酸濃度の関連を調べたところ、それらの間には強い負の相関が見られました。つまり、乳酸濃度が高いほどpHが低いということです(図4c)。乳酸は電離度が比較的高い酸であるため(水素イオンを放出しやすい)、この乳酸の増加が脳のpH低下に関連している可能性が考えられます。
その結果、今回調べた5種類のモデルマウスすべてにおいて、正常マウスに比べて遺伝子改変マウスで脳のpHが有意に低下していることを発見しました(図4a)。さらに、同じ溶液を用いて乳酸濃度を測定したところ、5系統のマウスで有意に増加していることもわかりました(図4b)。すべてのマウスのデータを統合してpHと乳酸濃度の関連を調べたところ、それらの間には強い負の相関が見られました。つまり、乳酸濃度が高いほどpHが低いということです(図4c)。乳酸は電離度が比較的高い酸であるため(水素イオンを放出しやすい)、この乳酸の増加が脳のpH低下に関連している可能性が考えられます。
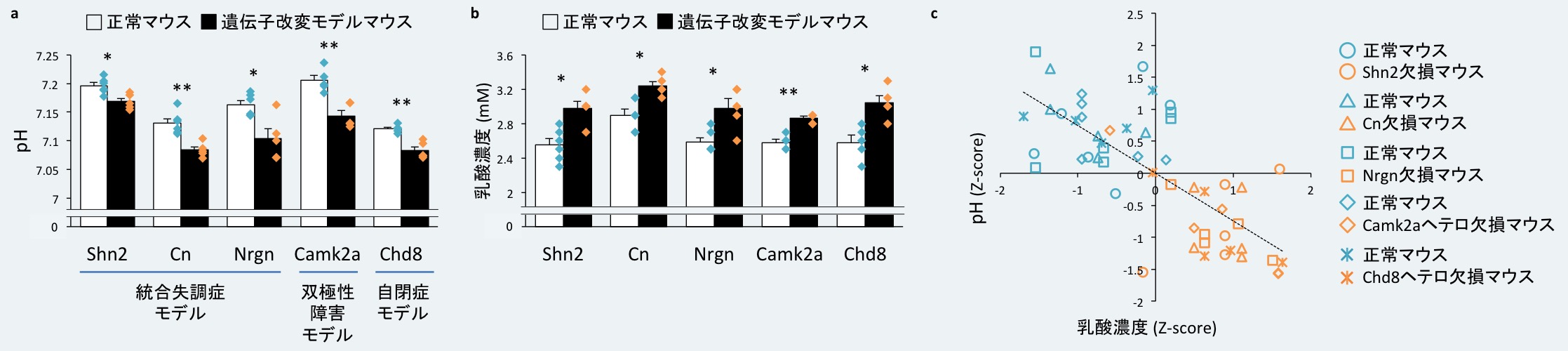
図4. 精神疾患モデルマウスの脳におけるpHの低下と乳酸濃度の増加
5系統のモデルマウスにおける脳のpH (a)と乳酸濃度 (b)の値の棒グラフ。アスタリスクは有意な差があることを示す (*P < 0.05, **P < 0.01: 多重検定補正後のP値)。(c) pHと乳酸濃度の値を、Zスコアを用いて標準化し、5系統のマウスのデータを統合して相関解析を行った。両者の間には有意な負の相関が見られた(ピアソンの相関係数r = -0.65, P = 1.19 x 10-7)。
5系統のモデルマウスにおける脳のpH (a)と乳酸濃度 (b)の値の棒グラフ。アスタリスクは有意な差があることを示す (*P < 0.05, **P < 0.01: 多重検定補正後のP値)。(c) pHと乳酸濃度の値を、Zスコアを用いて標準化し、5系統のマウスのデータを統合して相関解析を行った。両者の間には有意な負の相関が見られた(ピアソンの相関係数r = -0.65, P = 1.19 x 10-7)。
ヒト死後脳サンプルを用いた研究では、精神疾患に罹患していたかどうかという要因と同時に、混交要因となり得るさまざまな要因を考慮する必要があります。本研究におけるヒト死後脳pHデータの解析では、死戦期状態や死因、飲酒・喫煙歴など生前の環境などの要因についてはデータが得られなかったため考慮されておらず、これらの要因の健常者と罹患者との差が罹患者の脳pHの低下に寄与している可能性は否定できません。しかし、マウスを用いた研究ではそのような要因の影響を限りなく抑えることが可能です。今回のモデルマウスを用いた研究の結果は、pHの低下とそれに伴う乳酸の増加は単なる混交要因の影響の結果ではなく、精神疾患の疾患そのものに由来する変化であるという考えを強く支持するものです。本研究の結果はさらに新しい疑問をもたらします。例えば、乳酸濃度の増加とpHの減少はどのようなメカニズムによって制御されているのか? pH低下は脳の特定の領域で見られるのか、あるいは脳全体で見られるのか?脳pHの低下は精神疾患においてどのような機能的な意義を持っているのか、持っているとしたらそれは発症の原因なのか結果なのか?これらの問題に取り組むためにはさらなら研究が必要です。
今後の展望
脳のpH低下が精神疾患の病態に関連した現象であるという主張はこれまでにもありましたが(文献9)、混交要因の影響を受けた結果であるという考えのほうが主流でした。pHは遺伝子発現や細胞の機能にも影響する(文献10)ために制御すべき因子として扱われ、その制御のために多大な労力が費やされてきました。例えば、健常者群と罹患者群とでpHに差がない組織サンプルで解析を行う、遺伝子発現などの解析データをpHの情報に基づいて補正を行う、などです。しかし、pHの過度な制御により、pHの変化と関連して生じる現象を見逃してしまうかもしれません。脳内炎症や神経過剰活動はpHの変化と関連している可能性があります(図5)。これらは統合失調症などの発症機序に重要な役割を持っていると近年注目されてきている現象ですが、pHの制御により、このような重要な現象を正確に評価できなくなることも懸念されます。脳pHの低下は病態の一部であるという考えも、精神疾患の発症機序や脳内病態の解明にむけた研究において今後必要ではないかと考えています。
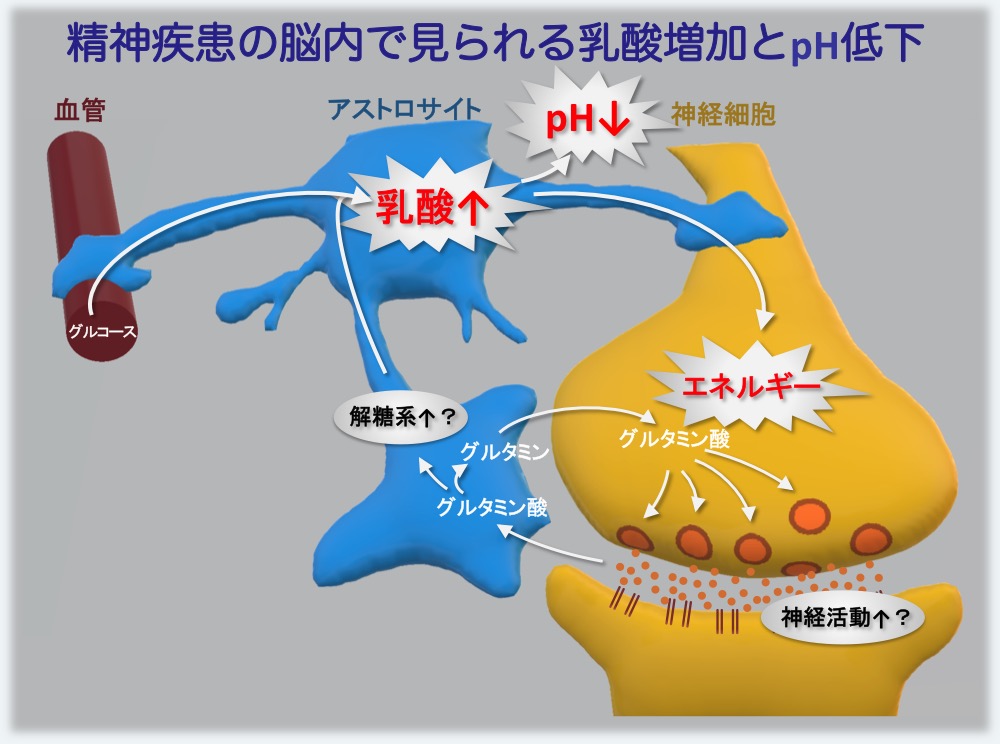
図5. pH低下に至る脳内現象の仮説
神経活動に伴い神経細胞から細胞外に放出された神経伝達物質グルタミン酸は、アストロサイト(グリア細胞の一種)で解糖系を刺激し、グルコースからの乳酸産生を促進する。神経過剰活動により乳酸が増加し、これがpHの低下に寄与すると考えられる。アストロサイトで作られた過剰の乳酸は、神経細胞に供給されて神経活動のエネルギー源として利用される。このような、「神経過剰活動—乳酸過剰産生」の循環が精神疾患の罹患者およびモデルマウスの脳内で起きていると想定している。
神経活動に伴い神経細胞から細胞外に放出された神経伝達物質グルタミン酸は、アストロサイト(グリア細胞の一種)で解糖系を刺激し、グルコースからの乳酸産生を促進する。神経過剰活動により乳酸が増加し、これがpHの低下に寄与すると考えられる。アストロサイトで作られた過剰の乳酸は、神経細胞に供給されて神経活動のエネルギー源として利用される。このような、「神経過剰活動—乳酸過剰産生」の循環が精神疾患の罹患者およびモデルマウスの脳内で起きていると想定している。
さらに我々は現在、モデルマウス研究の規模を拡大させて、国内外の20機関以上との共同研究で約30種類のマウス(遺伝子改変マウスや各種実験的操作を行ったマウスなど)の脳pHを網羅的に調べる研究を進めています。どのような脳内異常・行動異常を示すマウスがpHの変化を示すのかを網羅的に調べ、それらの関連が明らかになれば、精神疾患における脳pHの機能的な意義の解明につながるかもしれません。
本研究は、藤田保健衛生大学、ニューロサイエンスリサーチ・オーストラリア、ニューサウスウェールズ大学、九州大学、愛知県心身障害者コロニー発達障害研究所、理化学研究所、アメリカ国立衛生研究所、京都大学、スタンフォード大学の9機関の共同研究によって行われました。なお、本研究の一部は、JSPS科学研究費補助金(25242078、25116526、15H01297)、AMED脳科学研究戦略推進プログラム(融合脳)による支援を受けて行われました。
本研究は、藤田保健衛生大学、ニューロサイエンスリサーチ・オーストラリア、ニューサウスウェールズ大学、九州大学、愛知県心身障害者コロニー発達障害研究所、理化学研究所、アメリカ国立衛生研究所、京都大学、スタンフォード大学の9機関の共同研究によって行われました。なお、本研究の一部は、JSPS科学研究費補助金(25242078、25116526、15H01297)、AMED脳科学研究戦略推進プログラム(融合脳)による支援を受けて行われました。
| 今回の発表の内容は基礎研究の研究成果であり、これがすぐに臨床応用できるわけではありません。また、pHを上げるような方法で疾患が改善するということを証明しているわけではありません。 |
参考文献
- Halim ND, Lipska BK, Hyde TM, Deep-Soboslay A, Saylor EM, Herman M, et al (2008). Increased lactate levels and reduced pH in postmortem brains of schizophrenics: medication confounds. J Neurosci Methods 169: 208–213.
- Tomita H, Vawter MP, Walsh DM, Evans SJ, Choudary PV, Li J, et al (2004). Effect of agonal and postmortem factors on gene expression profile: quality control in microarray analyses of postmortem human brain. Biol Psychiatry 55: 346–352.
- Takao K, Kobayashi K, Hagihara H, Ohira K, Shoji H, Hattori S, et al (2013). Deficiency of Schnurri-2, an MHC enhancer binding protein, induces mild chronic inflammation in the brain and confers molecular, neuronal, and behavioral phenotypes related to schizophrenia. Neuropsychopharmacology 38: 1409–1425.
- Miyakawa T, Leiter LM, Gerber DJ, Gainetdinov RR, Sotnikova TD, Zeng H, et al (2003). Conditional calcineurin knockout mice exhibit multiple abnormal behaviors related to schizophrenia. Proc Natl Acad Sci U S A 100: 8987–8992.
- Hattori S, Hagihara H, Shoji H, Takamiya Y, Huang FL, Huang K-P, et al (2015). Neurogranin-deficient mice show behavioral abnormalities relevant to schizophrenia. SfN Meet 2015 Abstr.
- Yamasaki N, Maekawa M, Kobayashi K, Kajii Y, Maeda J, Soma M, et al (2008). Alpha-CaMKII deficiency causes immature dentate gyrus, a novel candidate endophenotype of psychiatric disorders. Mol Brain 1: 6.
- Hagihara H, Horikawa T, Nakamura HK, Umemori J, Shoji H, Kamitani Y, et al (2016). Circadian gene circuitry predicts hyperactive behavior in a mood disorder mouse model. Cell Rep 14: 2784–2796.
- Katayama Y, Nishiyama M, Shoji H, Ohkawa Y, Kawamura A, Sato T, et al (2016). CHD8 haploinsufficiency results in autistic-like phenotypes in mice. Nature 537: 675–679.
- Prabakaran S, Swatton JE, Ryan MM, Huffaker SJ, Huang JT-J, Griffin JL, et al (2004). Mitochondrial dysfunction in schizophrenia: evidence for compromised brain metabolism and oxidative stress. Mol Psychiatry 9: 684–697, 643.
- 富田博秋, 田中千晶, 兪志前 (2009). 交絡因子に配慮した脳バンク構築の必要性. 脳と精神の医学 20: 1.
用語説明
注1) pH(ピーエイチ、あるいはペーハー)
水溶液中の水素イオン濃度を表す指標。0〜14の範囲の数値で表され、7を中性とし、7より小さいと酸性を、7より大きいとアルカリ性を表す。正常ヒト血液のpHは7.38〜7.42に保たれている。
注2) 統合失調症
陽性症状(幻覚や妄想)、陰性症状(無関心、意欲の低下、社会性の低下)認知障害などが認められる精神疾患。
注3) 双極性障害
躁状態とうつ状態の二つの病相が周期的に交代して現れる精神疾患。日本人の生涯有病率は0.7%程度とされている。
注4) 自閉症
コミュニケーション異常や固執性などを主徴とする精神疾患。全人口の約2%が発症すると言われている。
注5) 死戦期
死亡に直結する病態の始まりから死亡に至るまでの期間(文献10)。死亡の直前には脳を体の種々の臓器の機能が失調をきたし、呼吸障害や循環器系不全、肝不全などの症状が現れてくる。
注6) プレパルス抑制
強い刺激、例えば大きな音をヒトや動物に突然与えると驚愕反応が引き起こされるが、その刺激の直前に微弱な刺激(小さな音)を提示すると驚愕反応が抑制されることが知られており、この現象をプレパルス抑制(PPI)と呼ぶ。統合失調症患者ではこのPPIが低下していることが報告されている。
水溶液中の水素イオン濃度を表す指標。0〜14の範囲の数値で表され、7を中性とし、7より小さいと酸性を、7より大きいとアルカリ性を表す。正常ヒト血液のpHは7.38〜7.42に保たれている。
注2) 統合失調症
陽性症状(幻覚や妄想)、陰性症状(無関心、意欲の低下、社会性の低下)認知障害などが認められる精神疾患。
注3) 双極性障害
躁状態とうつ状態の二つの病相が周期的に交代して現れる精神疾患。日本人の生涯有病率は0.7%程度とされている。
注4) 自閉症
コミュニケーション異常や固執性などを主徴とする精神疾患。全人口の約2%が発症すると言われている。
注5) 死戦期
死亡に直結する病態の始まりから死亡に至るまでの期間(文献10)。死亡の直前には脳を体の種々の臓器の機能が失調をきたし、呼吸障害や循環器系不全、肝不全などの症状が現れてくる。
注6) プレパルス抑制
強い刺激、例えば大きな音をヒトや動物に突然与えると驚愕反応が引き起こされるが、その刺激の直前に微弱な刺激(小さな音)を提示すると驚愕反応が抑制されることが知られており、この現象をプレパルス抑制(PPI)と呼ぶ。統合失調症患者ではこのPPIが低下していることが報告されている。