研究内容
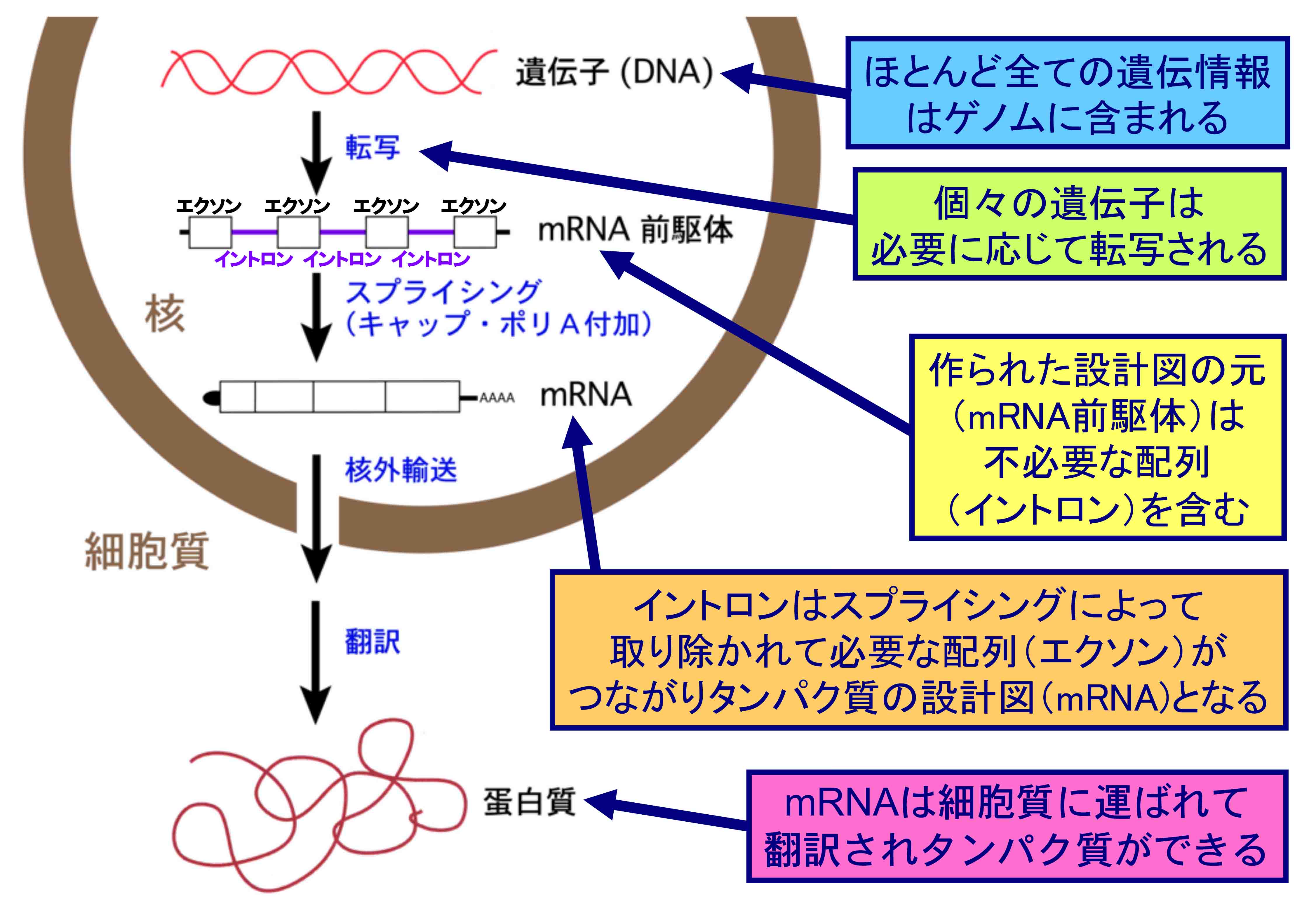
生物の基本単位である細胞の核の中に、生命活動をつかさどるほとんどすべての情報が遺伝子に含まれていますが、必要に応じて遺伝子は転写され mRNA前駆体ができ、そこからイントロンと呼ばれている不要な部分が丁寧に取り除かれて、やっとタンパク質の設計図であるmRNAができあがります。mRNAに不必要な イントロンを切り取り、必要なエクソンをつなぎ直す過程を『スプライシング』と呼んでいます(上図)。mRNAの連続した3つ の文字(塩基)がアミノ酸に対応するので、スプライシングは正確無比に行われなければ、目的のタンパク質を作れません。ひとたびスプライシングに狂いが生じると、細胞機能 に障害をひき起こし、しばしばがんや重い病気の原因になってしまいます(下図)。
ヒトを含む真核生物の遺伝子にイントロンが発見され、スプライシングという現象の存在が明らかになったのが1977年です。それから半世紀が近づい ているにも関わらず、驚くべきことに、その基本メカニズムにおいて、いまだに未解決な問題があります。私たちの研究室では、以下の3つの未解決問題に 取り組んでいます。
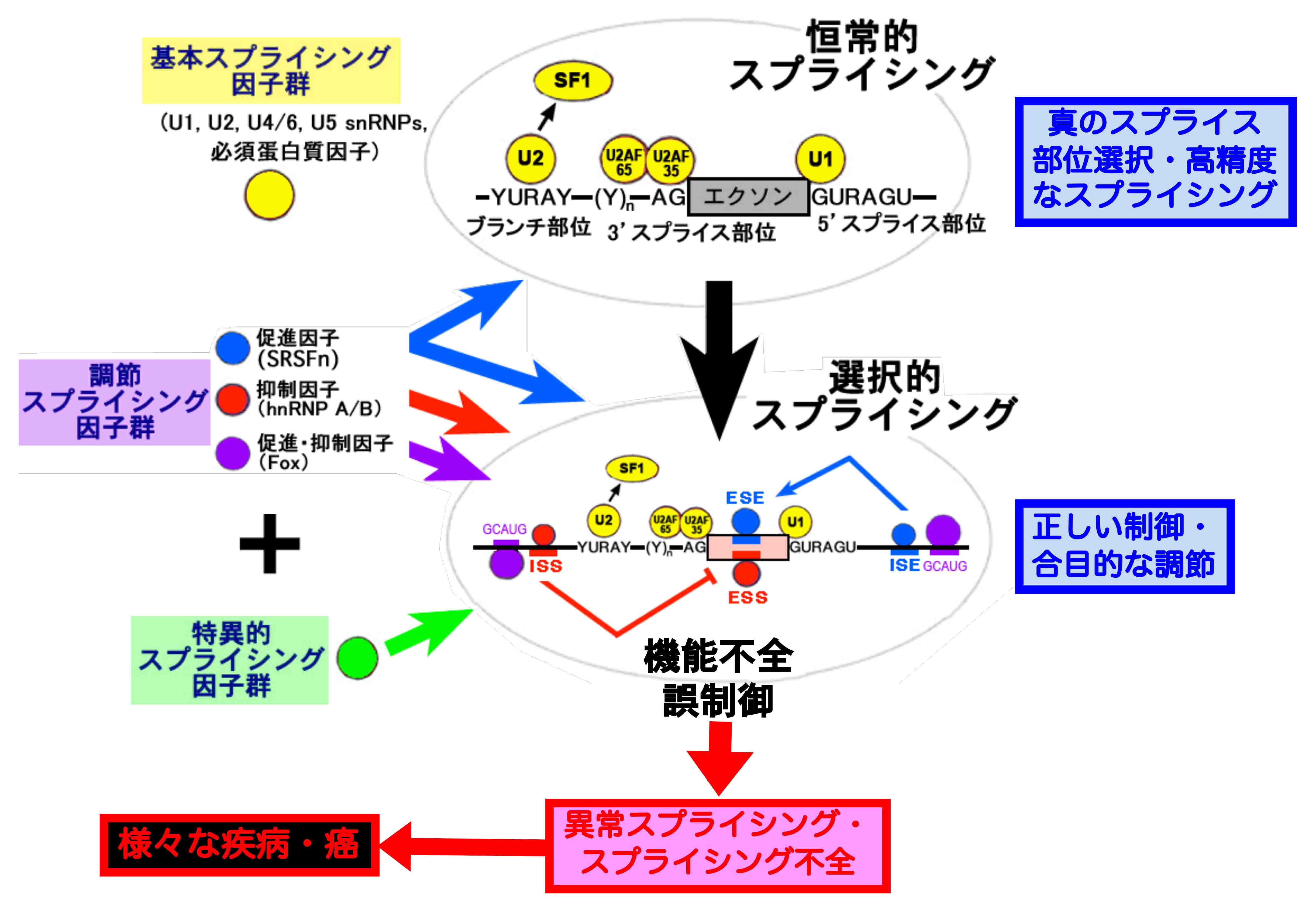
スプライシングは、どのようにして正確無比に行われているのだろう?
タンパク質の鋳型となるmRNAの品質を保つために、ナンセンス(未成熟終止)コドン依存的mRNA分解(Nonsense- mediated
mRNA decay,
NMD)に代表される、異常なmRNAを積極的に分解し排除する機構が知られていて、それはかなり研究されています。一方、正常な細胞では高い精度でスプライシングが遂行
されている厳然たる事実がありますが、実はその一般的なメカニズムは未だによくわかっていません。mRNA前駆体上には、真のスプライス部位に類似し
たスプライス部位様配列が散在していますが、どうしてそれらの偽のスプライス部位が選ばれず、真のスプライス部位が選択されるのでしょうか? スプラ
イス部位の強度をスプライス部位配列から定量化するプログラムがいくつかありますが、弱い真のスプライス部位が使われ、強い偽のスプライス部位が無視
されることも珍しくありません。もちろんスプライス部位の周りの配列が、真のスプライス部位の選択に関与している事実は、今では常識です。実際に、ス
プライシングを促進する効果のある配列(スプライシング・エンハンサー)と、逆にスプライシングを抑制する効果のある配列(スプライシング・サイレン
サー)が存在し、それに結合するスプライシング促進因子と抑制因子が多く知られています。しかし、真のスプライス部位が、高い精度で選ばれている事実
に対する合理的な説明は、まったくできていません。
もしスプライシング精度の維持に必須な因子があると仮定すると、その因子の発現を抑制すると、スプライシング精度が落ちて多くの異常スプライシング
が
引き起こされると考えられます。近年、このアプローチが効を奏し、その鍵を握る因子を同定することができました(「研究業績」-(B)参照)。その因子が、どのように関わ
り、 いかにして一般的にスプライシングの精度を上げているかを明らかにしようとしています。
スプライシングが完了する仕組みは、どうなっているのだろう?
スプライシングは、おそろしいほど複雑な過程で行われています。事実として分かっていることは、(1)スプライソソームと名づけられた(170種類
以上のタンパク質因子と5種類のsnRNA〜核内低分子RNA-タンパク質複合体〜を含む)非常に巨大なタンパク質-RNA複合体が動的に変化しなが
ら正確に行われています。(2)不要なイントロ
ンが取り除かれたmRNAは核外輸送され、細胞質でリボソームによってタンパク質に翻訳されます。(3)イントロンの両端には特徴的なスプライス部位配列(GUで始まり
AGで終わる)が
あり、それがスプライシングの目印となっています。なぜなら、その配列に変異が入るとたちどころにスプライシング異常が起こるからです。ところが先
に述べ
たように、スプライシングで使われないスプライシング部位に似た配列は、mRNA前駆体上のいたるところに数多く存在しています。スプライシングが完了
して、エクソン配列が結合した成熟mRNAも例外ではなく、それらに散在するスプライス部位様配列は通常は無視され、スプライシングが完了したなら
ば、スプ ライソソームは解離し、mRNAは核外輸送されます。さて、どのような仕組みで、スプライシングの完了が認識されるのでしょう?
スプライソソームを解離さ
せるためのタンパク質因子はいくつか知られていますが、成熟mRNAを認識し、スプライシングを完了させる機構の実体は、まだ明らかにされていません。
私たちは、この問題に挑戦するための絶好のモデルとなるmRNA前駆体基質と関与する候補因子を見いだしました。それは、癌特異的な長距離間の異常
ス
プライシングの「され方」、に注目したところに端を発しています。すなわち、成熟mRNAが再びスプライシングされて異常なmRNA産物ができている
という現象「mRNA再スプライシング」を発見したことです。この現象が、もし正常細胞で無秩序で起こったなら、正しいmRNAはできないわけですか
ら、深刻な害を及ぼすに違いありません。ならば、一旦完成された成熟mRNAは再びスプライシングされないような仕組みがあると考えられます(下
図)。そうなのです、このmRNA再スプライシング現象は、正常なスプライシングにおいて、スプライシングが完了するメカニズ
ム解明のためには打ってつけのモデル系となっているのです(下図)。
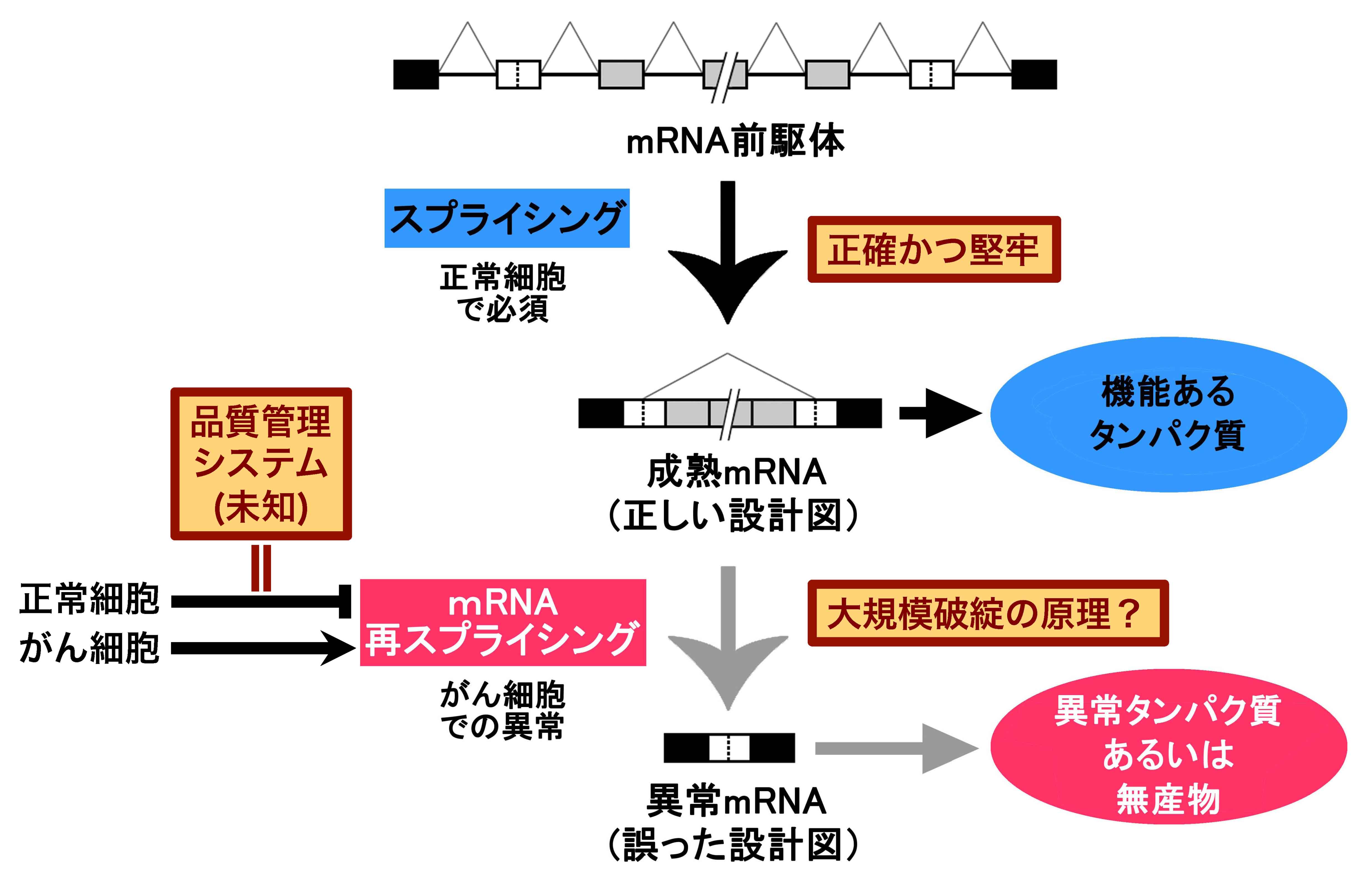
癌細胞内では、このような異常なmRNA再スプライシング現象がよく起こっているという事実から、正常細胞において、一旦スプライシングが完了し たmRNAを再びスプライシングさせない機構は、まさに未知のmRNA品質管理システムの根幹です(上図)。近年、その鍵を握る二つの因子を同定しま した (「研究業績」-(D)参照)。上記で述べた、スプライシングの精度保持機構と 共に、転写物全体(トランスクリプトーム)の正常化を維持するために重要に違いありません。
10万倍以上の長さの開きがあるイントロンが、なぜうまくスプライシングされるのだろう?
高等生物、とりわけヒトの遺伝子の不可思議は、その長さが著しく違うことです(例、LENEP gene: 736 bp、CNTNAP2
gene: 2304792
bp)。それは、ほぼ一定以下の長さに収まるエクソンではなく、イントロンの長さに大きな開きがあるのが原因です(例、ESRP2-intron
6: 43 bp、KCNIP4-intron 7: 1097903
bp)。このような、長さの差が2万5千倍を超えるイントロンが、まったく同じ因子とメカニズムでスプライシングされるとは考えにくいでしょう。
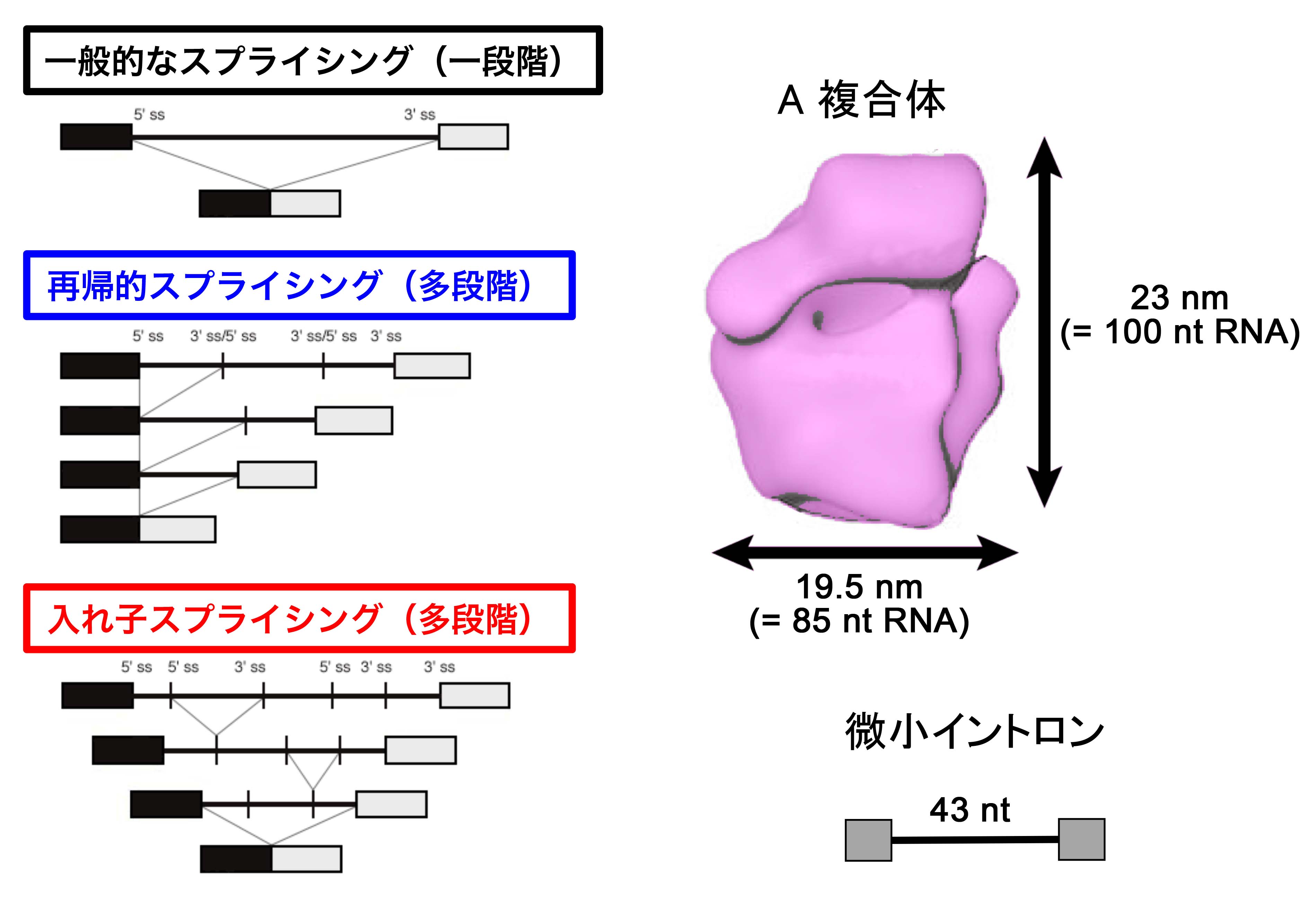
巨大なイントロンを取り除くスプライシングについては、多段階のスプライシングが関与していることは確実になってきています。次世代シーケンサーを
用いたヒト転写物の大規模解析のお陰で、長いイントロン内に再帰的スプライシング(Recursive
splicing)と呼ばれる現象が広範に起こっていることが2015年に実証されました。この再帰的スプライシングは、5′側から順繰りに起こるイントロン内スプライシ
ングです(下左図)。一方、私たちは、以前に分子生物学的な実験データから、入れ子スプライシング(Nested
splicing)の存在を提唱していたのですが(「研究業績」-(E)参照)、同様の次世代シーケンサーによる大規模解析によって、この入れ子スプライシング
の存在も、数多くの遺伝子で実証されました(下左図)。これは、内部のスプライシング完結後に再び外部のスプライシングが起こっている現象であり、構
造的には 上記のmRNA再スプライシングと相同の現象です(上図)。
微小なイントロンのスプライシング機構には、二つの原理的な謎があります。(1)
微小イントロン分子のサイズに比べ、スプライシング反応初期に形成されるA複合体のサイズが大きすぎて、微小イントロンに物理的に結合する余地がない(下右図)。(2)
微小イントロンが確実にスプライシングされているにも関わらず、スプライシングに必須の配列、すなわち5′スプライス部位配列、ブランチ部位配列、
3′スプライス部位配列が、まったく機能しない配列を含む微小イントロンが存在します(「研究業績」-(F)参照)。私たちは短いイントロン群のスプ
ライシングには、一般的なスプライシング基本因子と違う因子が関与しているのではないかと予想し、その同定に挑戦しています。
最近、既知のスプライシング因子U2AFに代わって新規の因子SPF45が関わっている短いイントロンの集合が存在することを証明しました(「研究
業績」-(F)参照)。しかしながら、上記(2)の有効なスプライス部位がない微小イントロンに関しては、そのスプライシング機構は、依然として謎の
ままです。どうやら、微小イントロンも本質的に異なるいくつかの部分集合に分けられることだけは確実なようです。