難病治療学研究部門
難病治療学研究部門ホームページ
藤田医科大学・医科学研究センター・難病治療学研究部門では、モデル動物を用いた難病の治療法開発、 微量にしか存在しない前駆細胞の単離、分化培養と再生医療、ナノテクノロジーの医学分野への応用に関する研究を最先端の手法を用いて行っています。
難病治療学研究部門 サイトはこちら
難病治療学研究部門 サイトはこちら
研究内容

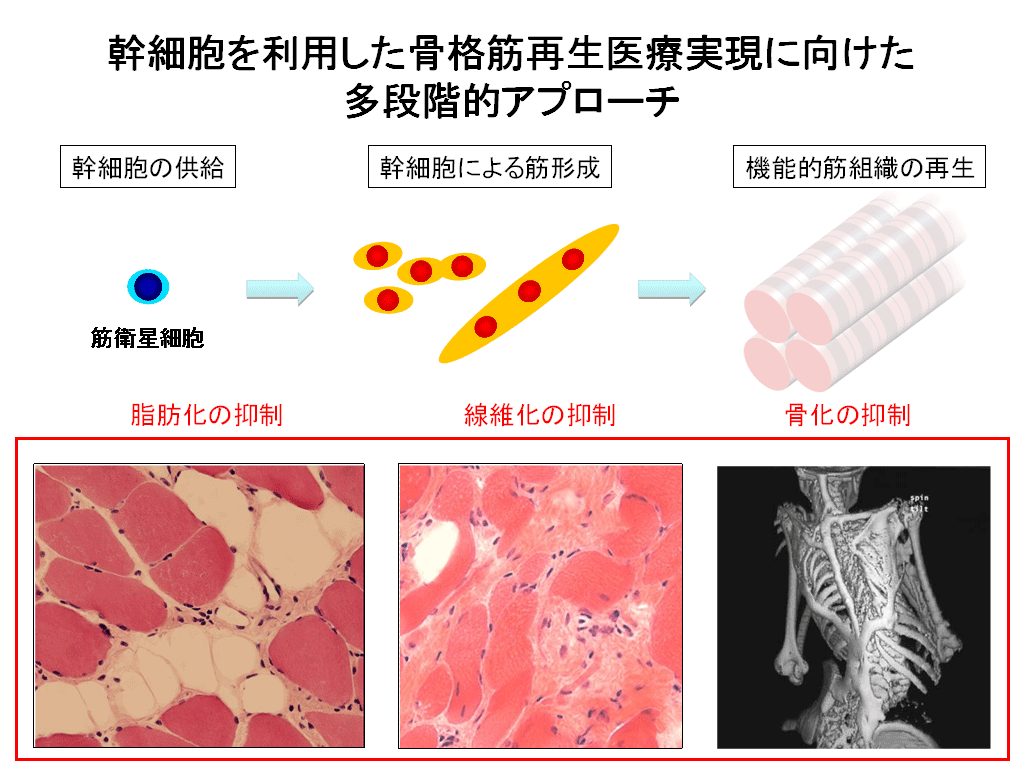
医科学研究センター・難病治療学研究部門は、難治性筋疾患や老化による筋萎縮、骨格系疾患、肥満と糖尿病、不安障害等の治療の困難な疾患を対象とした研究に取り組んでいます。疾患の分子病態解明とそれに基づいた治療法の開発を目指した研究を展開しています。
具体的な研究としては、一つには、筋ジストロフィーや老化で生じる筋萎縮(サルコペニア)を阻止する筋量増加と筋力上昇治療法に取り組んでいます。マイオスタチンやアクチビンはTGF-βファミリーに属するペプチド性の細胞増殖分化調節因子ですが、筋量を低下させる作用があります。そこで、これらを阻害することにより失われた筋量を取り戻し、筋力の向上が期待されます。独自に筋肥大モデルを作出し、詳細な解析を行っています。動物実験では筋ジストロフィーの症状を緩和することが示されています。マイオスタチン阻害によるによる筋肥大と小分子RNAの関与について最近明らかにしました。マイオスタチンが筋に高発現するのと比較して、アクチビンは神経組織等体内の多くの臓器で多彩な生理作用を発揮します。脳内のアクチビンとその阻害分子であるホリスタチンについて、過剰発現モデル動物を解析し、記憶や神経細胞分化や細胞死の調節作用があることがわかり、不安障害の病態解明と治療標的の探索をmRNA, miRNA,プロテオーム解析等の網羅的解析を駆使して行っています。
骨格筋は生体最重量の臓器であり、体の滑らかな動きを担うと共に、脂肪組織や他の臓器と相互作用し恒常性の維持に重要な役割を果たしています。特に、筋量増加時の脂肪組織の形態変化や抗肥満効果や骨への効果に着目した研究を行っています。こういった組織間相互作用の研究を展開しています。
筋内幹細胞/前駆細胞研究に関しては、近年急速な進展が見られていますが、本部門では、実験動物のみならずヒト骨格筋内にこれまで未同定の間葉系前駆細胞を見出し、脂肪細胞、骨細胞、軟骨細胞への分化過程や機能を詳細に解析しています。筋疾患や肥満、老化で見られる筋内脂肪沈着、繊維化、骨化の基となる可能性が高い興味深い細胞です。上記の病態は、筋疾患で見られます。さらに異所性骨化は、筋肉が骨になる疾患「進行性骨化性線維異形成症(FOP)」や外傷時にも見られます。臨床的にも重要な研究課題と考えられます。
研究手法としては、モデル動物を用いた難病の病態生理の解明と治療法開発、微量にしか存在しない幹細胞や前駆細胞の単離と分化培養を用いた再生医療に関する研究、筋疾患の病態と小分子RNA (miRNA)や長鎖非コードRNA(lncRNA)との関連を精査し医学分野へ応用する研究等を最先端の手法を用いて行っています。また、DNAアレイ、miRNAアレイ解析、プロテオミクスに関連した技術等を駆使した網羅的解析手法やsiRNAを用いた遺伝子機能阻害法等も数多く研究に取り入れています。
近年、ナノ粒子(カーボンナノ素材などの外因性微粒子やエクソソーム、マイクロベジクルなどの細胞内微粒子)の研究が盛んである。我々は、カーボンナノ素材を用いた癌や炎症の薬物送達系 (DDS)の開発を行ってきた。さらに、細胞内微粒子としてエクソソームの細胞内輸送や新たな翻訳後修飾系とエクソソーム内への分子の内包の重要性を明らかにする研究に着手し、着実に研究を推進させている。
上述の取り組みにより、治療が難しい疾患の病態が少しでも明らかとなり、近い将来に治療への突破口が開けていくことを期待しています。
具体的な研究としては、一つには、筋ジストロフィーや老化で生じる筋萎縮(サルコペニア)を阻止する筋量増加と筋力上昇治療法に取り組んでいます。マイオスタチンやアクチビンはTGF-βファミリーに属するペプチド性の細胞増殖分化調節因子ですが、筋量を低下させる作用があります。そこで、これらを阻害することにより失われた筋量を取り戻し、筋力の向上が期待されます。独自に筋肥大モデルを作出し、詳細な解析を行っています。動物実験では筋ジストロフィーの症状を緩和することが示されています。マイオスタチン阻害によるによる筋肥大と小分子RNAの関与について最近明らかにしました。マイオスタチンが筋に高発現するのと比較して、アクチビンは神経組織等体内の多くの臓器で多彩な生理作用を発揮します。脳内のアクチビンとその阻害分子であるホリスタチンについて、過剰発現モデル動物を解析し、記憶や神経細胞分化や細胞死の調節作用があることがわかり、不安障害の病態解明と治療標的の探索をmRNA, miRNA,プロテオーム解析等の網羅的解析を駆使して行っています。
骨格筋は生体最重量の臓器であり、体の滑らかな動きを担うと共に、脂肪組織や他の臓器と相互作用し恒常性の維持に重要な役割を果たしています。特に、筋量増加時の脂肪組織の形態変化や抗肥満効果や骨への効果に着目した研究を行っています。こういった組織間相互作用の研究を展開しています。
筋内幹細胞/前駆細胞研究に関しては、近年急速な進展が見られていますが、本部門では、実験動物のみならずヒト骨格筋内にこれまで未同定の間葉系前駆細胞を見出し、脂肪細胞、骨細胞、軟骨細胞への分化過程や機能を詳細に解析しています。筋疾患や肥満、老化で見られる筋内脂肪沈着、繊維化、骨化の基となる可能性が高い興味深い細胞です。上記の病態は、筋疾患で見られます。さらに異所性骨化は、筋肉が骨になる疾患「進行性骨化性線維異形成症(FOP)」や外傷時にも見られます。臨床的にも重要な研究課題と考えられます。
研究手法としては、モデル動物を用いた難病の病態生理の解明と治療法開発、微量にしか存在しない幹細胞や前駆細胞の単離と分化培養を用いた再生医療に関する研究、筋疾患の病態と小分子RNA (miRNA)や長鎖非コードRNA(lncRNA)との関連を精査し医学分野へ応用する研究等を最先端の手法を用いて行っています。また、DNAアレイ、miRNAアレイ解析、プロテオミクスに関連した技術等を駆使した網羅的解析手法やsiRNAを用いた遺伝子機能阻害法等も数多く研究に取り入れています。
近年、ナノ粒子(カーボンナノ素材などの外因性微粒子やエクソソーム、マイクロベジクルなどの細胞内微粒子)の研究が盛んである。我々は、カーボンナノ素材を用いた癌や炎症の薬物送達系 (DDS)の開発を行ってきた。さらに、細胞内微粒子としてエクソソームの細胞内輸送や新たな翻訳後修飾系とエクソソーム内への分子の内包の重要性を明らかにする研究に着手し、着実に研究を推進させている。
上述の取り組みにより、治療が難しい疾患の病態が少しでも明らかとなり、近い将来に治療への突破口が開けていくことを期待しています。
代表的な業績
1: Hitachi K, Nakatani M, Takasaki A, Ouchi Y, Uezumi A, Ageta H, Inagaki H, Kurahashi H, Tsuchida K. Myogenin promoter-associated lncRNA Myoparr is essential for myogenic differentiation. EMBO Rep. e47468. (2019) [Pubmed]
2: Ageta H, Ageta-Ishihara N, Hitachi K, Karayel O, Nakatani M, Kinoshita M, T. Ochiya T, Mann M, Setou M, Tsuchida K. 他. UBL3 modification influences protein sorting to small extracellular vesicles. Nature communications. 9; 3936. (2018) [Pubmed]
3: Hitachi K, Tsuchida K. Myostatin-deficiency in mice increases global gene expression at the Dlk1-Dio3 locus in the skeletal muscle. Oncotarget 8, 5943-53 (2017) [Pubmed]
4: Uezumi A, Nakatani M, Takeda S.-I., Nishino I, Tsuchida.他. Cell surface protein profiling identifies distinctive markers of progenitor cells in human skeletal muscle. Stem Cell Report 7(2) : 263-78 (2016) [Pubmed]
5: Uezumi A, Fukada S, Nakatani M, Tsuchida K. 他. Identification and characterization of PDGFRα mesenchymal progenitors in human skeletal muscle. Cell Death Disease (Nature Publishing Group) 5, e1186 (2014) [Pubmed]
6: Hitachi K, Nakatani M, Tsuchida K. Myostatin signaling regulates Akt activity via the regulation of miR-486 expression. Int J Biochem Cell Biol. 2014; 47: 93-103. [Pubmed][Faculty of 1000 recommended]
7: Ikeda D, Ageta H, Tsuchida K, Yamada H. iTRAQ-based proteomics reveals novel biomarkers of osteoarthritis. Biomarkers. 2013; 18(7): 565-72. [Pubmed][Faculty of 1000 recommended]
8: Oishi T, Uezumi A, Kanaji A, Yamamoto N, Yamaguchi A, Yamada H, Tsuchida K. Osteogenic differentiation capacity of human skeletal muscle-derived progenitor cells. PLoS One. 2013; 8(2): e56641. [Pubmed]
9: Nakatani M, Kokubo M, Ohsawa Y, Sunada Y, Tsuchida K. Follistatin-derived peptide expression in muscle decreases adipose tissue mass and prevents hepatic steatosis. Am J Physiol Endocrinol Metab. 2011; 300(3): E543-53. [Pubmed]
10: Uezumi A, Fukada S, Yamamoto N, Takeda S, Tsuchida K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 2010; 12(2): 143-52. [Pubmed][Faculty of 1000 recommended]
11: Nakatani M, Takehara Y, Sugino H, Matsumoto M, Hashimoto O, Hasegawa Y, Murakami T, Uezumi A, Takeda S, Noji S, Sunada Y, Tsuchida K. Transgenic expression of a myostatin inhibitor derived from follistatin increases skeletal muscle mass and ameliorates dystrophic pathology in mdx mice. FASEB J. 2008; 22(2): 477-87. [Pubmed]
2: Ageta H, Ageta-Ishihara N, Hitachi K, Karayel O, Nakatani M, Kinoshita M, T. Ochiya T, Mann M, Setou M, Tsuchida K. 他. UBL3 modification influences protein sorting to small extracellular vesicles. Nature communications. 9; 3936. (2018) [Pubmed]
3: Hitachi K, Tsuchida K. Myostatin-deficiency in mice increases global gene expression at the Dlk1-Dio3 locus in the skeletal muscle. Oncotarget 8, 5943-53 (2017) [Pubmed]
4: Uezumi A, Nakatani M, Takeda S.-I., Nishino I, Tsuchida.他. Cell surface protein profiling identifies distinctive markers of progenitor cells in human skeletal muscle. Stem Cell Report 7(2) : 263-78 (2016) [Pubmed]
5: Uezumi A, Fukada S, Nakatani M, Tsuchida K. 他. Identification and characterization of PDGFRα mesenchymal progenitors in human skeletal muscle. Cell Death Disease (Nature Publishing Group) 5, e1186 (2014) [Pubmed]
6: Hitachi K, Nakatani M, Tsuchida K. Myostatin signaling regulates Akt activity via the regulation of miR-486 expression. Int J Biochem Cell Biol. 2014; 47: 93-103. [Pubmed][Faculty of 1000 recommended]
7: Ikeda D, Ageta H, Tsuchida K, Yamada H. iTRAQ-based proteomics reveals novel biomarkers of osteoarthritis. Biomarkers. 2013; 18(7): 565-72. [Pubmed][Faculty of 1000 recommended]
8: Oishi T, Uezumi A, Kanaji A, Yamamoto N, Yamaguchi A, Yamada H, Tsuchida K. Osteogenic differentiation capacity of human skeletal muscle-derived progenitor cells. PLoS One. 2013; 8(2): e56641. [Pubmed]
9: Nakatani M, Kokubo M, Ohsawa Y, Sunada Y, Tsuchida K. Follistatin-derived peptide expression in muscle decreases adipose tissue mass and prevents hepatic steatosis. Am J Physiol Endocrinol Metab. 2011; 300(3): E543-53. [Pubmed]
10: Uezumi A, Fukada S, Yamamoto N, Takeda S, Tsuchida K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 2010; 12(2): 143-52. [Pubmed][Faculty of 1000 recommended]
11: Nakatani M, Takehara Y, Sugino H, Matsumoto M, Hashimoto O, Hasegawa Y, Murakami T, Uezumi A, Takeda S, Noji S, Sunada Y, Tsuchida K. Transgenic expression of a myostatin inhibitor derived from follistatin increases skeletal muscle mass and ameliorates dystrophic pathology in mdx mice. FASEB J. 2008; 22(2): 477-87. [Pubmed]
