構造生物学アプローチによる生体内高分子の機能解明
生命現象の多くは生体内で起る様々な化学反応が組み合わさって起っています。タンパク質といった生体内高分子は、この生体内で起る化学反応の中心的な役割を担っていて、酵素のように直接的に反応に関与する分子や、その酵素の活性を調節する役割をする分子が存在しています。我々のグループでは、生体内高分子がどのような形をしていて、それが生体内の化学反応にどのように関与しているのか?という点に興味を持っています。そして、生体内高分子が化学反応に関与している様子の立体構造を明らかにすることで、それらを目に見える形で解明しようと研究に取り組んでいます。
特に細菌の病原性、薬剤耐性のメカニズムの解明を目指している本研究室では、今後、これらに関わる生体内高分子の立体構造情報からもこれらの解明を目指し、そして、最終的には細菌感染症に対する治療薬候補化合物の提案や迅速な診断方法の開発に貢献できればと考えています。
下記にこれまでに明らかにした構造とその結果の概略を記します。
ウラシルDNAグリコシラーゼ(UDG)の酵素触媒機構の解明
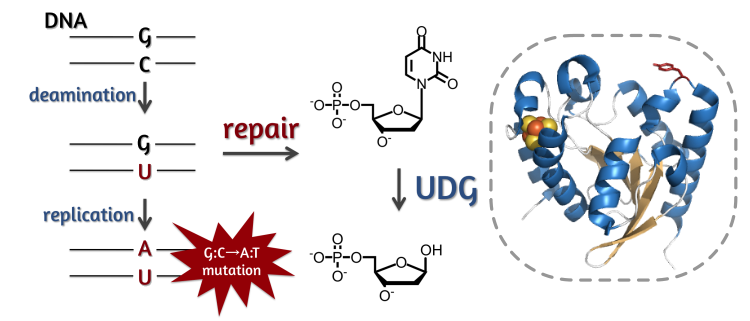
シトシンの脱アミノ化とUDGによる塩基除去機構
DNAを構成する塩基はグアニン、シトシン、アデニン、チミンの4種類だが、紫外線や放射線、活性酸素種など様々な要因により他の塩基が含まれてしまう場合がある。中でも、ウラシルは、シトシンの脱アミノ化によって生じる。このシトシンの脱アミノ化反応は生体内で自然発生していて、ウラシルが存在したままではアデニンと塩基対を形成していまうため、修復されずにDNAの複製が実施されるとG:C→A:Tの点突然変異の原因となってしまう。また、シトシンの脱アミノ化は酵素によって生じる場合があり、これらは抗体の多様性やウィルスの侵入を防ぐ手段など、生体防御の要として利用されていることが知られている。そして、いずれの場合においてもDNA中に生じたウラシルは、ウラシルDNAグリコシラーゼ(UDG)と呼ばれる酵素によって塩基部分が除去され、適切な生体内反応が開始される。
我々は好熱性古細菌Sulfolobus tokodaii由来ファミリー4 UDG(stoUDG)の結晶化に成功し、古細菌由来UDGとしては世界初となる立体構造を1.7 Å分解能で解明した。そして、酵素の全体構造やウラシル塩基の認識機構は他の生物種に存在するUDGと似ていていることを明らかにした。さらに、stoUDGはDNA結合時に重要なleucine-intercalation loopの構造に特徴があることを見出した。そして、変異体実験、DNA結合実験を行った結果、このleucine-intercalation loopに存在するTyr170がDNA結合に重要であること解明した。
※ 本研究は熊薬研究助成会の助成を受けました。
DNAクランプによるDNA複製、修復、組み換え制御機構の解明
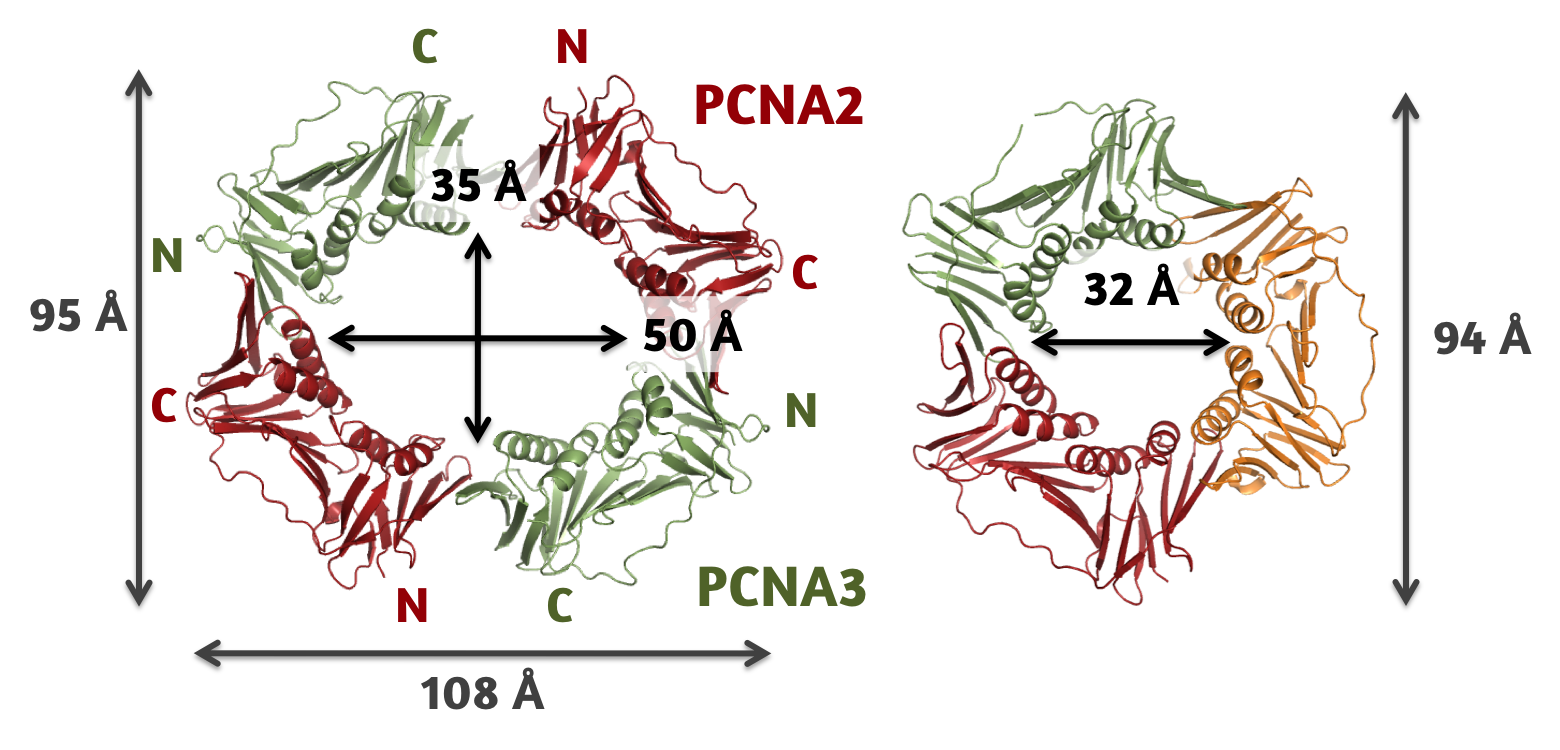
3量体型(右)と4量体型(左)DNAクランプ
DNAクランプの1種であるProliferating cell nuclear antigen (PCNA)は、DNA複製・修復の際にそれらに関与する酵素と相互作用し、酵素反応の足場として機能していると考えられている。PCNAは6つのドメインで構成されるリング状の構造を有し(図 右)、その中心の空洞は陽電荷に富んでいて、その特徴がDNAとの円滑な相互作用を可能にしている。crenarchaeaに属するSulfolobus tokodaii由来のPCNAは、他の多くの古細菌や真核生物と異なり、ヘテロ3量体を形成することでPCNAの特徴であるドーナツ状の構造を形成することが知られている。さらに、このヘテロ3量体を構成する3つの分子(PCNA1、PCNA2、PCNA3)のうち、PCNA1が欠けたPCNA2-PCNA3複合体も、3量体と同じぐらいの大きさの複合体を形成することが報告されている。
我々はX線結晶構造解析、X線溶液散乱、ゲルろ過カラムクロマトグラフィーの方法を用いてPCNA2とPCNA3のみで構成される複合体は、ヘテロ四量体で楕円状のリング構造を形成しているということを明らかにした(図 左)。現在、このヘテロ四量体型のDNAクランプの機能を解明することを目指し、研究を進めている。
ヒト血清アルブミン(HSA)と薬物、安定化剤に関する研究
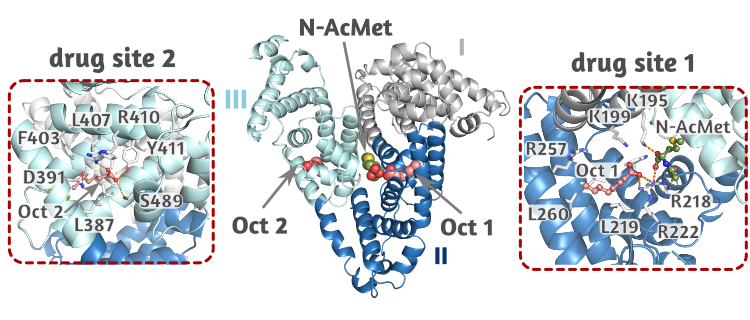
HSA構造中におけるOctおよびN-AcMetの結合部位
オクタン酸ナトリウム(Oct)はヒト血清アルブミン(HSA)の熱安定性を向上させ、N-アセチル-L-メチオニン(N-AcMet)はHSAの酸化を防ぐことが知られている。また、これらの分子は互いのHSA安定化効果を妨げないことも確認されている。そこで、本研究室では、崇城大学薬学部の小田切優樹 先生との共同研究で、OctとN-AcMetによるHSA安定化効果の分子機構を明らかにするため、HSA–Oct–N-AcMet三元複合体の立体構造解明を試みた。
構造解析の結果、Octの結合部位はHSAのサブドメインIIAとIIIAの2ヶ所で、いずれの部位でも分子内部に存在する疎水性ポケットに1分子ずつ結合していた。一方、N-AcMetの結合部位はサブドメインIIAに存在していて、サブドメインIIAポケットの入口部分に水素結合を介して結合し、酸化を受けやすい側鎖は溶媒領域に露出されていた。これらの結果から、OctによるHSA熱安定化効果は、HSAサブドメインIIIA分子内部の相互作用領域が増加したことに起因すると考えられ、また、N-AcMetによる抗酸化効果は、側鎖が溶媒領域に露出していることからHSAへの結合に影響されることなく発揮されると考えられる。
※ 本研究成果は、国立研究開発法人医療研究開発機構 創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)の支援により得られました。
ヒト血清アルブミン(HSA)とナテグリニドの構造化学研究

ACS Med Chem Lett掲載号の表紙
速効型インスリン分泌促進薬ナテグリニドは、血漿タンパク結合率が99%以上と極めて高いことが知られている。崇城大学の山﨑啓之教授らの研究グループは、ナテグリニドが主にヒト血清アルブミン(HSA)のサブドメインIIIAに結合することを明らかにしていたが、その詳細な結合様式は不明であった。
我々は今回、HSA–ナテグリニド複合体の結晶構造を 2.8 Å 分解能で決定した。結晶構造解析の結果、非対称単位中には2分子のHSAが含まれており、それぞれに結合したナテグリニドの配向が異なっていた。分子動力学(MD)シミュレーションの結果、これら2種類の結合様式はいずれもポケット内で安定に保持されていることが示された。さらに、MM/PBSA法による結合自由エネルギーの計算では、molA: -8.94 ± 0.03 kcal/mol、molB: -10.00 ± 0.04 kcal/mol という値が得られ、等温滴定型カロリメトリーによる実測値 -7.66 ± 0.11 kcal/mol(n = 0.66 ± 0.02)と良く一致した。
これらの結果は、溶液中においても2種類の結合様式が存在することを強く示唆している。すなわち、同一の結合ポケット内においても複数の安定した結合様式が成立しうることを明らかにした。
*本研究成果は掲載号の表紙にも採択されました。
