疾病等報告
疾病等とは
「疾病等」とは、特定臨床研究の実施に起因するものと疑われる疾病、障害若しくは死亡又は感染症に加え、臨床検査値の異常や諸症状を含みます。
研究責任医師(多施設共同研究の場合は統括管理者)は、特定臨床研究の実施について、疾病等を知ったときは、それぞれに定める期間内に実施医療機関の管理者に報告した上で、認定臨床研究審査委員会(・厚生労働大臣)に報告しなければいけません。
報告期限
1.未承認又は適応外の医薬品等を用いる研究
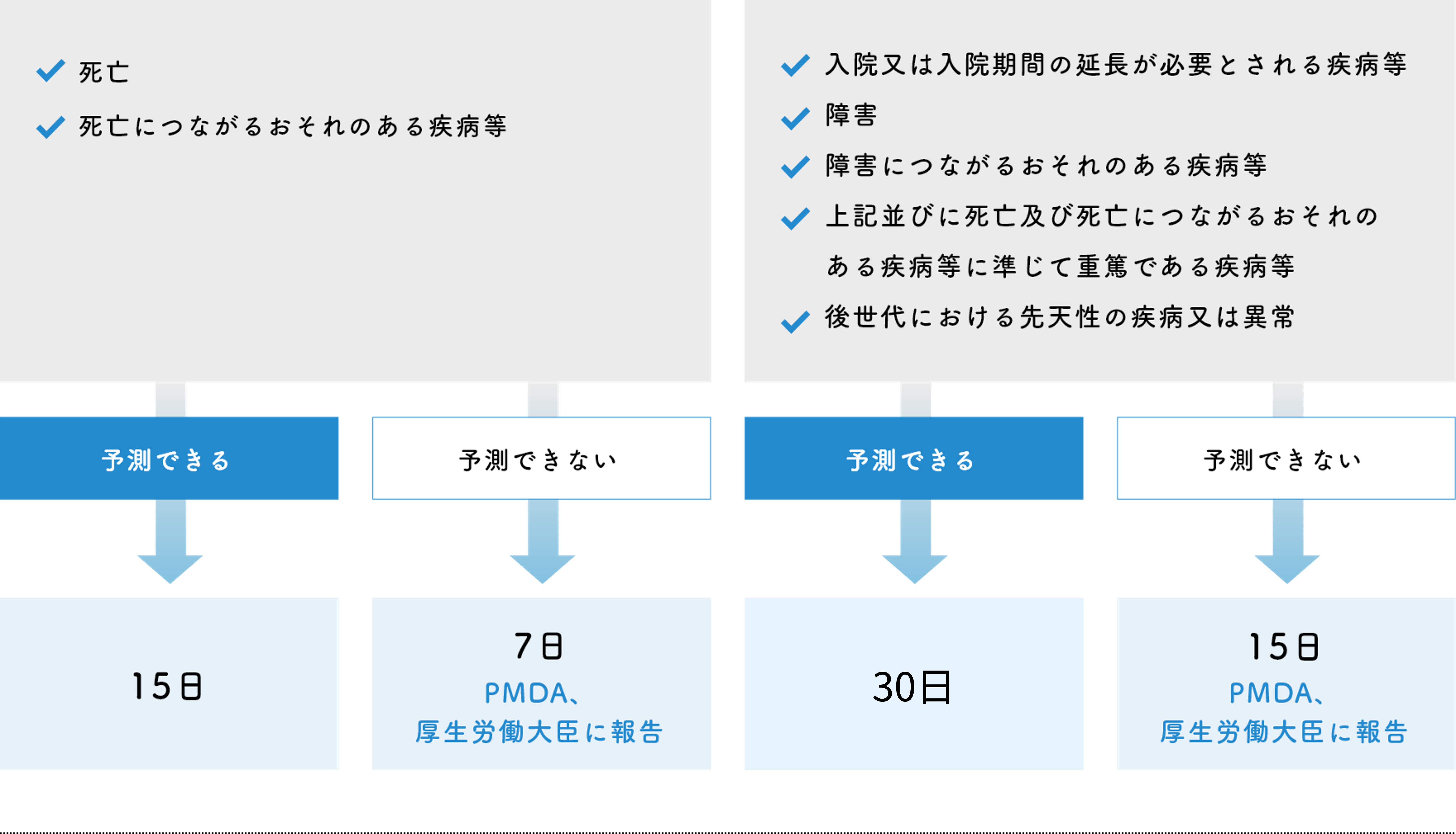
2.既に承認されている医薬品等を用いる研究(未承認又は適応外の医薬品等を用いる研究以外の特定臨床研究)

3.医療機器・再生医療等製品の特定臨床研究における不具合によって、次の疾病等が発生するおそれのある場合

注意事項
報告期限内に疾病等の因果関係が判断できない場合
判明している範囲で第1報を報告期限内に報告したうえで、その後に続報を報告する。この場合、続報が報告期限内でなくてもよい。
認定臨床研究審査委員会と実施医療機関の管理者への報告の順番
実施医療機関の管理者に報告したうえで、認定臨床研究審査委員会に報告することになっているが、状況に応じて、報告が前後することは問題ない
医薬品等製造販売業者への情報提供
疾病等報告(定期報告での報告を除く)を行う際は、同時に被験薬の製造販売をし、又はしようとする医薬品等製造販売業者へ情報提供を行うこと。
既に承認されている医薬品等の疾病等における「感染症」とは
生物由来製品において、生物由来の原料又は材料から、当該医薬品等への病原体の混入が疑われる場合等を指すこと。
また、HBV、HCV、HIV等のウイルスマーカーの陽性化についても、感染症報告の対象となる(臨床研究法施行規則の施行について (66))
有害事象(倫理指針)と 疾病等(臨床研究法)について
特定臨床研究の実施中に疾病や不具合が発生した際には実施医療機関の管理者および認定臨床研究審査委員会(・厚生労働大臣)に報告しなければなりません。
有害事象(倫理指針)
実施された研究との因果関係の有無を問わず、研究対象者に生じた全ての好ましくない又は意図しない傷病若しくはその徴候(臨床検査値の異常を含む。)。
疾病等(臨床研究法)
特定臨床研究の実施に起因するものと疑われる疾病、障害若しくは死亡又は感染症。
