事例・研究
Case
研究紹介 case001【三原先生】
国際再生医療センターにおける研究概要

国際再生医療センターは免疫療法、特にキメラ型抗原レセプター(chimeric antigen receptor: CAR)T細胞療法の開発を中心として研究を行っています。標的抗原は多種にわたり、様々な疾患、特に悪性腫瘍(造血器腫瘍(骨髄腫、悪性リンパ腫、急性骨髄性白血病、成人T細胞白血病/リンパ腫など)・固形腫瘍(膠芽腫など))に対し注力し、日夜研究を続けています。
研究開発プロジェクト
1)CD38-CAR-T細胞療法の臨床応用
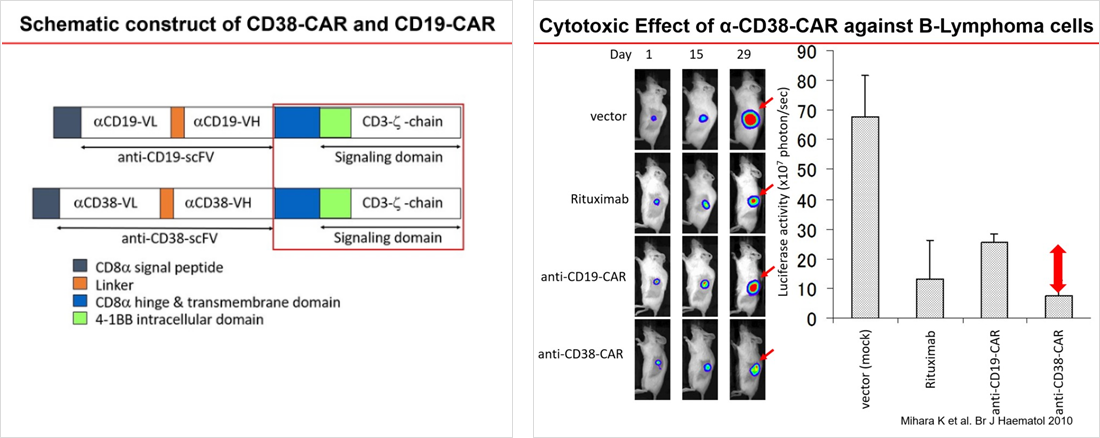
これまで三原らはKymriah®のインサートの研究開発に従事した経験を踏まえ2004年にCD38-CARを作成し、実験を重ね、特許を取得しました。このCD38-CAR-T細胞は多発性骨髄腫、悪性リンパ腫、急性骨髄性白血病、成人T細胞白血病/リンパ腫などで効果がin vitroおよびin vivoで認められました。臨床応用に向けて、さらに研究開発を行っています。
2)固形腫瘍に対するCARバックボーンベクターの作製
Tisagenlecleucel(Kymriah®)、axicabtagene ciloleucel(Yescarta®)など有効性が確認され、臨床的に承認されているものは造血器腫瘍のみです。多くの固形腫瘍に対してはいまだCAR-T細部療法の明らかな有効性は見出せていないという状況です。そこで、患者さんが最も多い悪性腫瘍である固形腫瘍に対し、CARのバックボーンベクターを作成しています。
3)サイトカイン放出症候群(cytokine release syndrome: CRS)を抑制するベクターの作製
CRSはCAR-T療法の際に高頻度で出現し、かつ重篤化します。これまで抗IL-6受容体抗体(Tocilizumab: Actemra®)の投与で死亡率は激減しましたが、今もなお数%の頻度で死亡に至ります。また、中枢神経にCRSが波及した場合はTocilizumabでは基本的に効果が乏しく、サイトカイン放出症候群(cytokine release syndrome: CRS)を抑制するベクターの開発が急務とされています。このベクターの開発にも注力しています。
4)膠芽腫に対するCAR-T細胞療法の開発
悪性度のきわめて高い脳腫瘍である膠芽腫に対し、CAR-T細胞療法の開発を進めています。これは2)3)の開発と並行し、きわめて特異的かつ安全なベクターを現在作成中です。
Kasahara Y, Shin C, Kubo N, Mihara K, Iwabuchi H, Takachi T, Imamura M, Saitoh A, Imai C. Development and characterisation of NKp44-based chimeric antigen receptors that confer T cells with NK cell-like specificity. Clin Transl Immunology 9(7):e1147 2020
Mihara K, Yoshida T, Bhattacharyya J. Basic Procedures for Detection and Cytotoxicity of Chimeric Antigen Receptors. Methods Mol Biol 1904:299-306 2019
Mihara K, Yoshida T, Takei Y, Sasaki N, Takihara Y, Kuroda J, Ichinohe T. T cells bearing anti-CD19 and/or anti-CD38 chimeric antigen receptors effectively abrogate primary double-hit lymphoma cells. J Hematol Oncol 10(1):116 2017
Yoshida T, Mihara K, Ishida S, Takei Y, Kitanaka A, Shimoda K, Morishita K, Takihara Y, Ichinohe T. All-trans retinoic acid and interferon-a increase CD38 expression on adult T-cell leukemia cells and sensitize them to T cells bearing anti-CD38 chimeric antigen receptors. Blood Cancer J 6(5):e421 2016
Yoshida T, Mihara K, Takei Y, Yanagihara K, Kubo T, Bhattacharyya J, Imai C, Mino T, Takihara Y, Ichinohe T. All-trans retinoic acid enhances cytotoxic effect of T cells with an anti-CD38 chimeric antigen receptor in acute myeloid leukemia. Clin Transl Immunology 5(12):e116 2016
Bhattacharyya J, Mihara K, Kitanaka A, Yanagihara K, Kubo T, Takei Y, Kimura A, Takihara Y. T-cell immunotherapy with a chimeric receptor against CD38 is effective in eradicating chemotherapy-resistant B-cell lymphoma cells overexpressing survivin induced by BMI-1. Blood Cancer J 2(6):e75 2012
Mihara K, Bhattacharyya J, Kitanaka A, Yanagihara K, Kubo T, Takei Y, Asaoku H, Takihara Y, Kimura A. T-cell immunotherapy with a chimeric receptor against CD38 is effective in eliminating myeloma cells. Leukemia 26(2):365-7 2012
Mihara K, Yanagihara K, Takigahira M, Kitanaka A, Imai C, Bhattacharyya J, Kubo T, Takei Y, Yasunaga S, Takihara Y, Kimura A. Synergistic and persistent effect of T-cell immunotherapy with anti-CD19 or anti-CD38 chimeric receptor in conjunction with rituximab on B-cell non-Hodgkin lymphoma. Br J Haematol 151(1):37-46 2010
Mihara K, Yanagihara K, Takigahira M, Imai C, Kitanaka A, Takihara Y, Kimura A. Activated T-cell-mediated immunotherapy with a chimeric receptor against CD38 in B-cell non-Hodgkin lymphoma J Immunother 32(7):737-43 2009
Imai C, Mihara K, Andreansky M, Nicholson IC, Pui CH, Geiger TL, Campana D. Chimeric receptors with 4-1BB signaling capacity provoke potent cytotoxicity against acute lymphoblastic leukemia 18(4):676-84 Leukemia 2004