米国の臨床試験登録データベースClinicalTrials.govを用いて、軟骨細胞治療に関する臨床開発のグローバルトレンドを網羅的に解析
本研究のポイント
・軟骨損傷の細胞治療では、2014-15年に臨床試験のトレンドの変化があり、軟骨や骨髄から脂肪を細胞の材料として用いることがメジャーとなった。
・由来臓器別に研究の進展度をサブ解析したところ、フェーズIIIまで実施しているのは主に軟骨と臍帯であり市販されてもいるが、骨髄や脂肪では試験数が多いもののこれまでのところフェーズIIIは限られ、市販されている製品はなかった。
・このように、ある領域の臨床試験を開始から完了(予定)までをラダーチャートとして表し、様々な属性解析を行うことによって、その領域の臨床試験のグローバルな動向を俯瞰することが可能となった。
ClinicalTrials.govは、米国の臨床試験登録データベースであり、200以上の国々からの臨床試験の実施状況に関する情報を提供する世界最大の臨床試験登録サイトです。このサイトは臨床試験の結果をほとんど提供しませんが、個々の臨床試験計画のデータベースとして、対象疾患、スポンサー/主任研究者、臨床試験の計画とプロトコール、被験者の登録に関する情報ほかを提供します。さらに、データベースは、計画された臨床試験の内容の詳細に関する情報を包括的に提供するので、各臨床試験計画から属性データを抽出することによって、様々な標的解析を行うことが可能となります。
関節軟骨の欠損や変性病変は、患者の生活の質を大きく低下させます。現在までに外科的治療を含む様々な治療法が開発されていますが、確実な治療法はまだ知られていません。20世紀の終わりから細胞療法による軟骨欠損修復の試みが行われ、実際に米国、欧州、韓国および日本では、すでにいくつかの細胞療法製品が市販されています。しかしながら、われわれが知る限り、これまでClinicalTrials.govデータレジストリに基づいた細胞療法に関する臨床研究動向の網羅的解析についての科学的な報告はありませんでした。
この報告では、ClinicalTrials.govから得られたデータに基づいて、軟骨修復のための細胞治療製品に焦点を当て、各属性別に応じて色分けした横バーで個々の臨床試験の開始から終了までをあらわし、これらを時系列に集積して俯瞰することで、これまでとらえることが困難であった再生医療の臨床開発におけるグローバルな動向の大きな流れを把握することを可能としました。
本成果は、以下の事業・研究課題等によって得られました。
再生医療の実現化ハイウェイ(AMED)
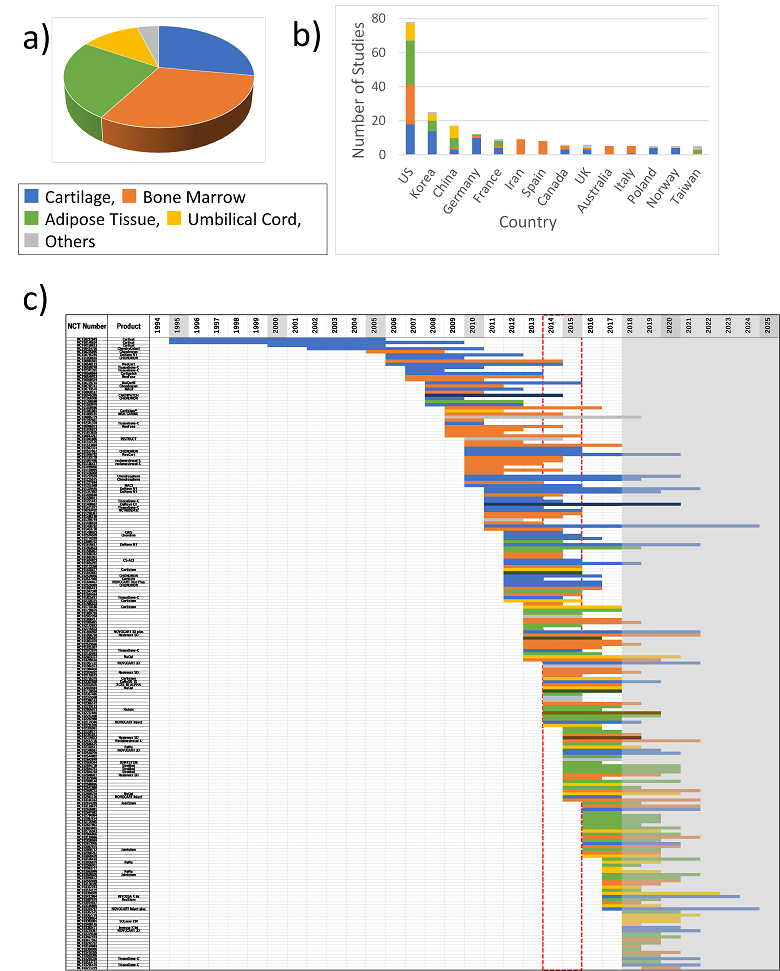 図1 軟骨損傷の細胞治療臨床試験に用いられた細胞の由来臓器に関する解析
図1 軟骨損傷の細胞治療臨床試験に用いられた細胞の由来臓器に関する解析
a) 通常行われるパイチャートによる解析です。この領域の臨床試験のそれぞれに用いられた細胞の由来臓器の割合を示します。由来臓器は骨髄が最も多く、軟骨、脂肪と続くことがわかります。
b) それぞれの国別の件数を示しています。総数では米国がとびぬけて多く、韓国、中国他が追いかけているのがわかります。また、国により用いる細胞の由来にも偏りがあることがわかります。
c) 臨床試験個々の開始年から完了(予定)年までを着色した横バーで示し、それらを時系列に集積してラダーチャートとして表したものです。横バーの色分けはa)b)とおなじです。2014-15年に臨床試験のトレンドの変化があり、軟骨や骨髄から脂肪用いることがメジャーとなったことがわかります。
同様に、用いた細胞が自家・他家いずれかについても同様の解析を行いましたが、特にいずれかからいずれかへの変遷などは認められませんでした(図略)。
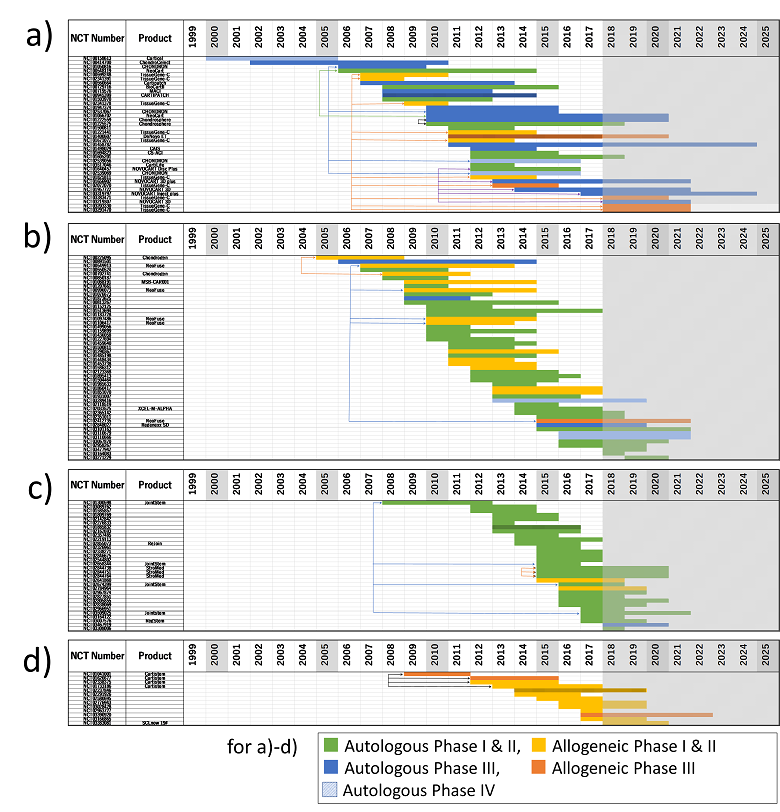 図2 臨床試験の開発進展度を主要な細胞由来臓器別にサブグループ解析
図2 臨床試験の開発進展度を主要な細胞由来臓器別にサブグループ解析
これらは細胞由来臓器別の各サブグループについて、その臨床試験に用いた細胞の自家・他家の別と、その試験のフェーズを同時に解析したものです。フェーズIIIを実施するためにはそれ以前にその治療法の安全性とある程度の有効性をヒトで確認しておく必要があるため、臨床試験のフェーズがフェーズIII以降であるか否かによっておおよその開発進展度がわかります。横バーの配色を上記のように変更しているので注意してください。
a) 軟骨由来の細胞を用いた臨床試験のラダーチャートです。早い時期から青色が多いのは、1998年から自己の軟骨を採取して体外で増殖させ、それを患部に移植して修復する製品が米国で承認され市販されていたことによります。このような自家軟骨を利用する方法では、軟骨採取時と移植時、2回の外科手術が必要となりますが、このような欠点を改善するため様々な改良法が試みられ、いくつかは製品化されています。その一つの流れとして他家軟骨の利用があり、この図ではフェーズIIIがオレンジで示されています。これらのうちの一つ、Invossaは細胞レベルの遺伝子治療製品で、昨年韓国で承認されました。
b) 骨髄由来細胞を用いた臨床試験のラダーチャートです。骨髄は試験数は最も多いですが、非常に精力的に研究されている割には青やオレンジはわずかで、実際に世界で製品になっているものはまだありません。
c) 脂肪由来の細胞を用いた臨床試験のラダーチャートです。脂肪も軟骨に匹敵するほど多いですが、研究が活発になる時期が遅いこともあり、フェーズIIIはまだ認められず、製品もありません。
d) 臍帯由来の細胞を用いた臨床試験のラダーチャートです。臍帯では特別な場合を除いて原理的に他家のみとなります。総数は少ないですが、すでに2012年に臍帯血由来の間葉系幹細胞を用いたCARTISTEMが韓国で承認されています。
以上、今回は軟骨修復領域の細胞治療に着目して解析したところ、2014-15年に細胞材料について軟骨や骨髄から脂肪へのトレンドの変化があったこと、また軟骨を材料とした場合に比べて骨髄や脂肪は臨床開発の成功確度が低いことがわかりました。このように、ClinicalTrials.govの登録情報を用いてある領域の臨床試験を開始年から完了(予定)年までをラダーチャートとして表し、様々な属性解析を行うことによって、その領域の臨床試験のグローバルな動向を俯瞰することが可能となりました。
<論文情報>
“Trends in clinical trials for articular cartilage repair by cell therapy”
(細胞療法による関節軟骨修復の臨床試験におけるトレンド)
npj Regenerative Medicine 3, 17 (2018)
【 お問い合わせ先 】
<研究内容に関すること>
藤田医科大学 再生医療学講座
教授 松山 晃文
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地 98
Email: reg-sec@fujita-hu.ac.jp
<報道・プレスリリースについて>
藤田医科大学 広報部 学園広報課
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地 98
Tel: 0562-93-2492・2868
Email: koho-pr@fujita-hu.ac.jp


