ヒトES細胞およびヒトiPS細胞から下垂体ホルモン産生細胞を高効率かつ高純度で作製する方法を開発
名古屋大学大学院医学系研究科糖尿病・内分泌内科学の多賀 詩織 共同研究員(兼 住友ファーマ株式会社、筆頭著者)、須賀 英隆 准教授(責任著者)および有馬 寛 教授らと、住友ファーマ株式会社再生・細胞医薬神戸センターの桑原 篤 グループマネージャー、住友化学株式会社生物環境科学研究所の中野 徳重 主任研究員および藤田医科大学医学部生理学の長崎 弘 教授らの共同研究グループは、ヒト胚性幹細胞(ヒトES 細胞)※1 およびヒト人工多能性幹細胞(ヒトiPS細胞)※1 を用い、高効率かつ高純度で下垂体ホルモン産生細胞を作製する方法を開発しました。
下垂体は様々なホルモンの制御中枢で、中でも副腎皮質刺激ホルモン(ACTH)※2 は日内変動や各種ストレスにより需要が変動します。下垂体機能低下症に対する現行の補充療法ではこの需要変動に供給を合わせられず、生命予後に影響を及ぼす場合があります。
本共同研究グループは2016年にヒトES細胞から、2020年にヒトiPS細胞から下垂体-視床下部組織を作製可能にしました。今回はこれらの方法を基盤としてヒト臨床での使用を想定して改良し、ヒトES細胞およびヒトiPS細胞から安定的かつ高効率で下垂体-視床下部組織を作製可能としました。さらに下垂体表面抗原※3 マーカーのEpCAMを用いたセルソーティング(細胞選別)を加えることで、高純度の下垂体ホルモン産生細胞を作製可能としました。精製して再凝集した下垂体ホルモン産生細胞(3D-下垂体)を下垂体機能不全モデルマウスに移植したところ、半年以上に渡ってホルモン分泌能が改善し、ホルモン分泌制御や疑似感染ストレスへの応答を示すことを確認しました。
本研究の成果は下垂体の機能が低下した患者に対する再生医療の実現に向け、一歩前進したものと言えます。
本研究はAMED難治性疾患実用化研究事業「ヒト多能性幹細胞を用いた下垂体前葉機能低下症への再生医療技術開発」の支援を受けて実施され、2023年6月8日付の米国科学誌『Stem Cell Reports』誌オンライン版に掲載されます。
本研究グループは2016年にヒトES細胞から、2020年にヒトiPS細胞から下垂体-視床下部組織を作製することに成功しました。再生医療の実現に向けては、ヒト臨床で使用可能な基準を想定しつつ、効率良く純度の高い下垂体ホルモン産生細胞を作製する必要がありました。
しかしながら今回開発した分化誘導法であっても、下垂体-視床下部組織における下垂体と視床下部への分化誘導、特に後者を厳密に一定に制御することが難しいという課題が残りました。そこで、下垂体表面抗原マーカーのEpCAMを用いたセルソーティングを行い、下垂体-視床下部組織から下垂体ホルモン産生細胞のみを単離することで、高純度な下垂体組織の作製を目指しました。さまざまな条件を検討し、例えば細胞の選別時期については分化60日以降のセルソーティングが望ましいことが分かりました。精製後に再凝集した細胞(3D-下垂体)はACTH産生細胞を豊富に含む高純度な下垂体ホルモン産生細胞で構成され、試験管の中で高いACTH分泌能を示しました。この3D-下垂体が生体内と同様の制御を受けて下垂体ホルモンを分泌するかどうか、まず試験管内で検討しました。副腎皮質刺激ホルモン放出ホルモン(CRH)※5 を作用させるとACTHの分泌が増加し、デキサメサゾン※6 を作用させるとACTHの分泌が抑制されることを確認しました(図2)。
次に、移植した生体内でもこの3D-下垂体が機能するか(有効性)を確かめるために、下垂体を除去したマウス(下垂体機能不全モデルマウス)に3D-下垂体を移植して検討しました。移植した細胞はマウス内で半年以上生着し、マウス血中ACTH濃度の改善を認めました(図3)。さらにホルモンの反応性を検討したところ、環境に対応する応答性も持ち合わせることが示唆されました。例えば、デキサメサゾン投与状態では移植細胞にきちんと抑制がかかり、ACTHは分泌されませんでした。この結果は、移植後も分泌が止まるべき時に止まり、移植細胞からの分泌過剰によって副作用が引き起こされるリスクが低いことを示唆しています(図4)。また、疑似感染ストレスとしてリポ多糖(LPS:Lipopolysaccharide)※7 投与を行ったところ、LPSに反応してACTH分泌が増加しました。すなわち風邪などの強いストレスがかかった緊急時(sick day)には移植片からACTHが追加分泌されることで急性副腎不全に陥るリスクを低減可能であることを示唆しています(図5)。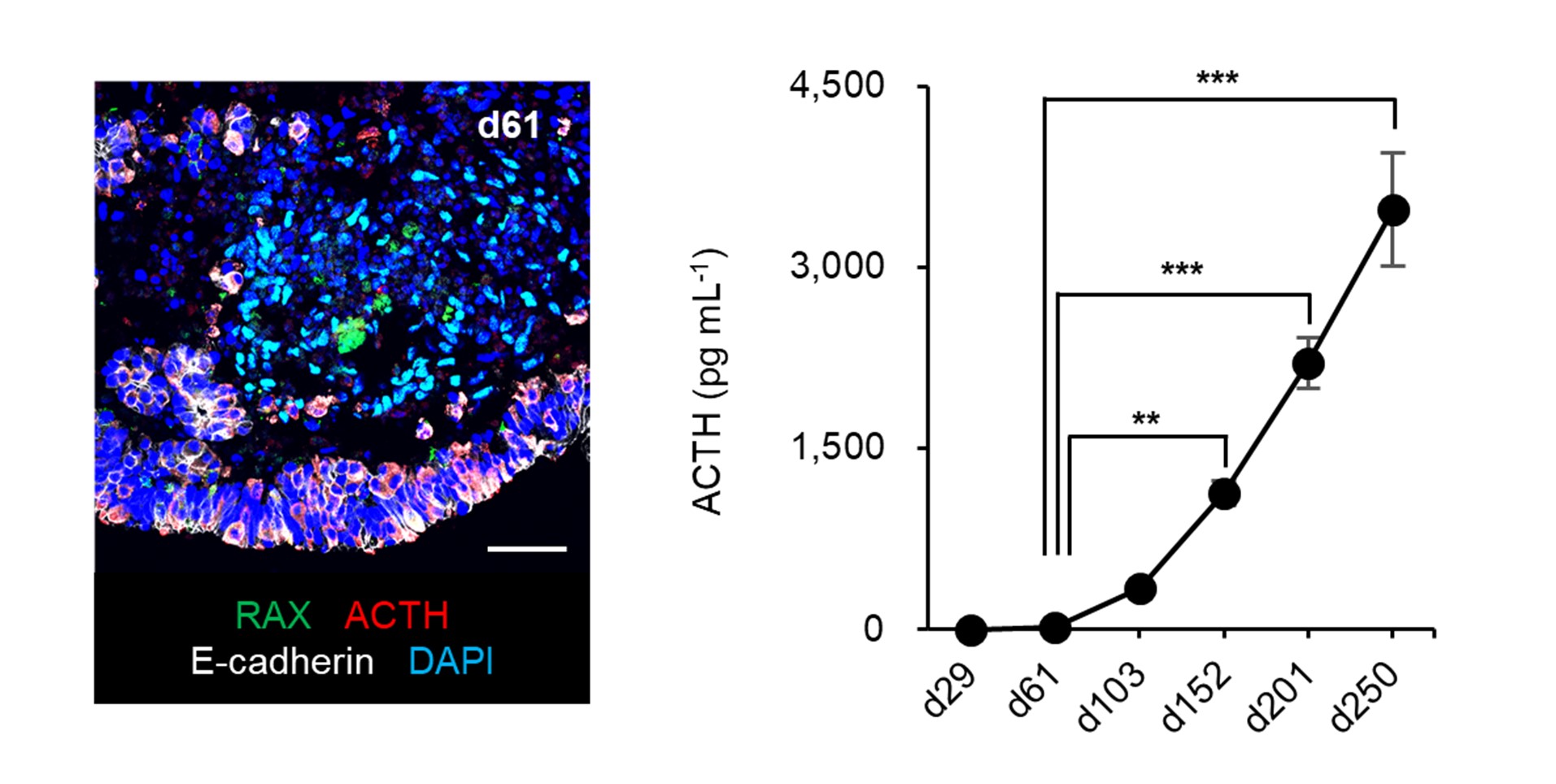
下垂体は様々なホルモンの制御中枢で、中でも副腎皮質刺激ホルモン(ACTH)※2 は日内変動や各種ストレスにより需要が変動します。下垂体機能低下症に対する現行の補充療法ではこの需要変動に供給を合わせられず、生命予後に影響を及ぼす場合があります。
本共同研究グループは2016年にヒトES細胞から、2020年にヒトiPS細胞から下垂体-視床下部組織を作製可能にしました。今回はこれらの方法を基盤としてヒト臨床での使用を想定して改良し、ヒトES細胞およびヒトiPS細胞から安定的かつ高効率で下垂体-視床下部組織を作製可能としました。さらに下垂体表面抗原※3 マーカーのEpCAMを用いたセルソーティング(細胞選別)を加えることで、高純度の下垂体ホルモン産生細胞を作製可能としました。精製して再凝集した下垂体ホルモン産生細胞(3D-下垂体)を下垂体機能不全モデルマウスに移植したところ、半年以上に渡ってホルモン分泌能が改善し、ホルモン分泌制御や疑似感染ストレスへの応答を示すことを確認しました。
本研究の成果は下垂体の機能が低下した患者に対する再生医療の実現に向け、一歩前進したものと言えます。
本研究はAMED難治性疾患実用化研究事業「ヒト多能性幹細胞を用いた下垂体前葉機能低下症への再生医療技術開発」の支援を受けて実施され、2023年6月8日付の米国科学誌『Stem Cell Reports』誌オンライン版に掲載されます。
ポイント
- ヒトES細胞およびヒトiPS細胞からヒト臨床での使用を想定した分化誘導法の開発を行い、下垂体-視床下部組織を安定的かつ高効率に作製可能とした。
- EpCAMを用いたセルソーティング(細胞選別)によって細胞を精製することで、高純度な下垂体ホルモン産生細胞を作製可能になった。
- 下垂体機能不全モデルマウスへの移植による、長期の有効性と環境に応答する分泌制御とが確認された。
- この方法を応用することで、下垂体機能低下症患者への再生医療に貢献することが期待される。
1. 背景
下垂体はさまざまなホルモンを制御する中心で、司令塔とも言うべき働きをしており、恒常性・成長・代謝・ストレス反応・生殖など多岐にわたる生命現象をコントロールしています。従って、もし下垂体の機能が低下すると様々な症状を引き起こします。特に下垂体でACTHが低下すると、副腎不全を起こして生命の危機に陥ることもあります。現在、下垂体機能低下症に対する根治療法は存在せず、不足しているホルモンを投与する補充療法が行われています。しかしながらホルモンの必要量は状況に応じて変動するため、現行の補充治療では十分には対応できない場合があり、補充不足による副腎不全や補充過多による医原性クッシング症候群※4などの発生リスクがあります。もし生体と同じように周囲の環境に応答する下垂体ホルモン産生細胞が作製でき、それを臨床使用可能なレベルに洗練させることができれば、これまでの補充療法よりも優れた治療法になる可能性があります。本研究グループは2016年にヒトES細胞から、2020年にヒトiPS細胞から下垂体-視床下部組織を作製することに成功しました。再生医療の実現に向けては、ヒト臨床で使用可能な基準を想定しつつ、効率良く純度の高い下垂体ホルモン産生細胞を作製する必要がありました。
2. 研究成果
本研究グループが2016年と2020年に報告した下垂体-視床下部組織の作製法は、胎児におけるこの部位のでき方を試験管内で再現するところに特徴があります。今回、ヒト臨床で使用することを想定した下垂体-視床下部組織の分化法を開発するにあたって、下垂体の発生を試験管内でより精密に再現することを目指し、新たにWntおよびTGFβシグナルの阻害物質を作用させました。その結果、作製した下垂体-視床下部組織のうち、ほぼすべての細胞塊がACTH産生細胞を含んでおり(図1)、以前の培養方法では約30%であったのと比較して安定性と効率とが大きく改善しました。しかしながら今回開発した分化誘導法であっても、下垂体-視床下部組織における下垂体と視床下部への分化誘導、特に後者を厳密に一定に制御することが難しいという課題が残りました。そこで、下垂体表面抗原マーカーのEpCAMを用いたセルソーティングを行い、下垂体-視床下部組織から下垂体ホルモン産生細胞のみを単離することで、高純度な下垂体組織の作製を目指しました。さまざまな条件を検討し、例えば細胞の選別時期については分化60日以降のセルソーティングが望ましいことが分かりました。精製後に再凝集した細胞(3D-下垂体)はACTH産生細胞を豊富に含む高純度な下垂体ホルモン産生細胞で構成され、試験管の中で高いACTH分泌能を示しました。この3D-下垂体が生体内と同様の制御を受けて下垂体ホルモンを分泌するかどうか、まず試験管内で検討しました。副腎皮質刺激ホルモン放出ホルモン(CRH)※5 を作用させるとACTHの分泌が増加し、デキサメサゾン※6 を作用させるとACTHの分泌が抑制されることを確認しました(図2)。
次に、移植した生体内でもこの3D-下垂体が機能するか(有効性)を確かめるために、下垂体を除去したマウス(下垂体機能不全モデルマウス)に3D-下垂体を移植して検討しました。移植した細胞はマウス内で半年以上生着し、マウス血中ACTH濃度の改善を認めました(図3)。さらにホルモンの反応性を検討したところ、環境に対応する応答性も持ち合わせることが示唆されました。例えば、デキサメサゾン投与状態では移植細胞にきちんと抑制がかかり、ACTHは分泌されませんでした。この結果は、移植後も分泌が止まるべき時に止まり、移植細胞からの分泌過剰によって副作用が引き起こされるリスクが低いことを示唆しています(図4)。また、疑似感染ストレスとしてリポ多糖(LPS:Lipopolysaccharide)※7 投与を行ったところ、LPSに反応してACTH分泌が増加しました。すなわち風邪などの強いストレスがかかった緊急時(sick day)には移植片からACTHが追加分泌されることで急性副腎不全に陥るリスクを低減可能であることを示唆しています(図5)。

図1:ヒトES細胞から作製した下垂体-視床下部組織の細胞塊
左の図は、成熟した下垂体-視床下部組織の断面図です。細胞塊の外側にACTH産生細胞(赤色)を含む下垂体(白色)が、細胞塊の内側に視床下部(緑色)が存在しています。右のグラフは、作製した下垂体-視床下部組織からのACTH分泌能力が経時的に上昇することを示しています。
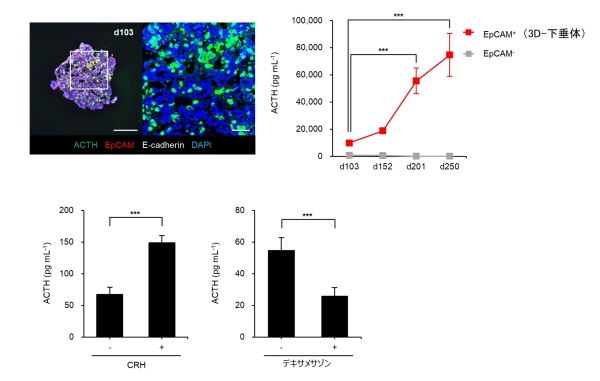
図2:精製した3D-下垂体と試験管内でのホルモン分泌機能評価
左上の図は、精製後に再凝集した下垂体ホルモン産生細胞(3D-下垂体)の断面図です。全体が下垂体細胞(赤色および白色)で構成されており、ACTH産生細胞(緑色)を多く含有しています。右上のグラフは、その3D-下垂体からのACTH分泌能力を示しており、長期培養することで ACTH分泌能が増加することを試験管内の実験で示しています。左下のグラフは、CRHに反応してACTH分泌が増加すること、右下のグラフはデキサメサゾンに反応してACTH分泌が抑制されることを示しています。
3D-下垂体の下垂体機能不全モデルマウスへの移植による有効性評価
左の図は、成熟した下垂体-視床下部組織の断面図です。細胞塊の外側にACTH産生細胞(赤色)を含む下垂体(白色)が、細胞塊の内側に視床下部(緑色)が存在しています。右のグラフは、作製した下垂体-視床下部組織からのACTH分泌能力が経時的に上昇することを示しています。

図2:精製した3D-下垂体と試験管内でのホルモン分泌機能評価
左上の図は、精製後に再凝集した下垂体ホルモン産生細胞(3D-下垂体)の断面図です。全体が下垂体細胞(赤色および白色)で構成されており、ACTH産生細胞(緑色)を多く含有しています。右上のグラフは、その3D-下垂体からのACTH分泌能力を示しており、長期培養することで ACTH分泌能が増加することを試験管内の実験で示しています。左下のグラフは、CRHに反応してACTH分泌が増加すること、右下のグラフはデキサメサゾンに反応してACTH分泌が抑制されることを示しています。

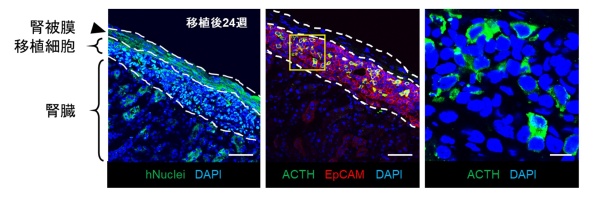
図3:移植後24週間の移植細胞の様子
この3つの図は、移植後24週間の移植細胞の様子です。
左から順に(a)ヒト核陽性細胞(緑色)、(b)下垂体細胞(赤色)とACTH産生細胞(緑色)、(c)拡大して撮影したACTH産生細胞(緑色)を示しています。ヒト細胞である3D-下垂体が移植部位にきちんと生着していることを示しています。
この3つの図は、移植後24週間の移植細胞の様子です。
左から順に(a)ヒト核陽性細胞(緑色)、(b)下垂体細胞(赤色)とACTH産生細胞(緑色)、(c)拡大して撮影したACTH産生細胞(緑色)を示しています。ヒト細胞である3D-下垂体が移植部位にきちんと生着していることを示しています。

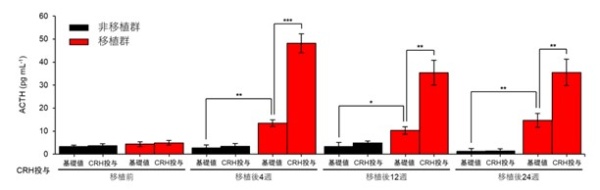
図4:移植群での血中ACTH濃度(非移植群との比較)
このグラフは、移植群での血中ACTH濃度を、非移植群と比較して示しています。移植により血中ACTH濃度(基礎値)が改善し、CRH投与に反応してACTHが増加するという性質を再現できました。この効果は少なくとも移植後24週まで認められました。
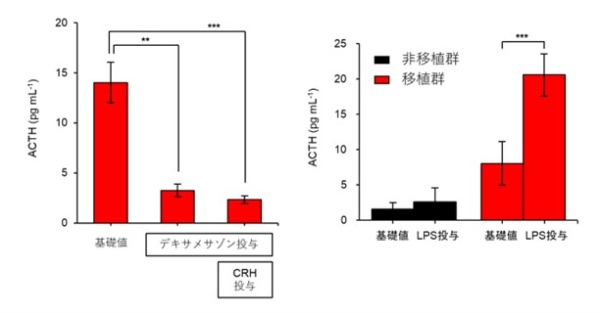
図5:移植群での血中ACTH濃度(薬剤投与への応答性)
これらのグラフも血中ACTH濃度を示しています。左のグラフは、デキサメサゾン投与によりACTH分泌が抑制されています(真ん中の棒グラフ)。デキサメサゾン投与で抑制をかけつつ、さらにCRH投与で分泌刺激を加えたとしても、ACTH分泌は抑制されたままでした(右の棒グラフ)。右のグラフは、LPS投与に反応してACTH分泌が増加することを示しています。
このグラフは、移植群での血中ACTH濃度を、非移植群と比較して示しています。移植により血中ACTH濃度(基礎値)が改善し、CRH投与に反応してACTHが増加するという性質を再現できました。この効果は少なくとも移植後24週まで認められました。

図5:移植群での血中ACTH濃度(薬剤投与への応答性)
これらのグラフも血中ACTH濃度を示しています。左のグラフは、デキサメサゾン投与によりACTH分泌が抑制されています(真ん中の棒グラフ)。デキサメサゾン投与で抑制をかけつつ、さらにCRH投与で分泌刺激を加えたとしても、ACTH分泌は抑制されたままでした(右の棒グラフ)。右のグラフは、LPS投与に反応してACTH分泌が増加することを示しています。
3. 今後の展開
ヒトES細胞およびヒトiPS細胞を材料にして、ヒト臨床での使用を想定しつつ高効率で高純度な下垂体ホルモン産生細胞を作製可能にしたことで、下垂体の機能が低下した患者に対する再生医療の実用化に向けて一歩前進しました。今後、本研究成果をもとに、臨床投与方法や併用薬等の臨床プロトコルの検討、臨床用細胞を製造するための大スケール化・さらなる高効率化等の製法検討、非臨床安全性評価を行い、下垂体の再生医療の実現化に向けた研究開発を進めていきます。
4. 用語説明
※1 胚性幹細胞(ES細胞)・人工多能性幹細胞(iPS細胞)
胚性幹細胞(ES細胞)とは発生初期の動物胚に存在する内部細胞塊から作られる細胞で、あらゆる種類の体細胞へ分化する能力とほぼ無限に増殖する能力を合わせ持つ多能性幹細胞の1つである。人工多能性幹細胞(iPS細胞)は皮膚や血液などの体細胞に遺伝子を導入することによって得られる多能性幹細胞である。
※2 副腎皮質刺激ホルモン(ACTH)
下垂体から分泌されるホルモンの一つ。副腎皮質に作用し副腎皮質ホルモンの分泌を促進する働きをする。視床下部からの副腎皮質刺激ホルモン放出ホルモン(CRH)により分泌が刺激される。デキサメサゾンなどの糖質コルチコイドが充分に存在する場合は、分泌が抑制される。
※3 表面抗原
細胞の表面に発現している抗原である。細胞表面抗原に蛍光色素を標識した抗体を反応させることで細胞を生きたまま選別することが可能である。
※4 医原性クッシング症候群
クッシング症候群とは副腎で合成・分泌されるコルチゾール(副腎皮質から分泌されるホルモンの一種)の作用が過剰になることで、体重増加、顔が丸くなる、血糖値・血圧が高くなるという症状を引き起こす病気である。副腎のコルチゾールは下垂体からのACTHが分泌を調節している。医原性とは医療行為が原因となって起こることである。
※5 副腎皮質刺激ホルモン放出ホルモン(CRH)
視床下部から分泌されるホルモンの一つ。生体では、下垂体に作用してACTHの分泌を促進する(正の制御)。
※6 デキサメサゾン
糖質コルチコイド、あるいはステロイドなどと呼ばれる薬剤の一つ。生体にデキサメサゾンを投与すると、ネガティブフィードバックと呼ばれる作用を介して、下垂体からのACTH分泌が抑制される(負の制御)。
※7 リポ多糖(LPS:Lipopolysaccharide)
グラム陰性細菌の細胞壁表層にある脂質と糖質からなる分子。LPSは毒性を含む様々な生理活性を示し、病原性細菌のLPSは、宿主の免疫系により感染のシグナルとして認識される。
5. 発表雑誌
掲載誌名
Stem Cell Reports
論文タイトル
Generation and purification of ACTH-secreting hPSC-derived pituitary cells for effective transplantation
著者・所属
多賀 詩織1,2、須賀 英隆1、中野 徳重3、桑原 篤2、井下 尚子4、小谷 侑5、長崎 弘5、佐藤 好隆6、津村 悠介7、榊原 真弓1、宗圓 美香1、三輪田 勤1、尾崎 創1、加納 麻弓子8、渡 健治2、池田 篤史2、山中 貢9、高橋 康彦3、北本 幸子3、川口 頌平1、宮田 崇1、小林 朋子1、杉山 摩利子1、尾上 剛史1、安田 康紀1、萩原 大輔1、岩間 信太郎1、冨ケ原 祥隆3*、木村 徹2、有馬 寛1
1. 名古屋大学大学院医学系研究科 糖尿病・内分泌内科学
2. 住友ファーマ株式会社 再生・細胞医薬神戸センター
3. 住友化学株式会社 生物環境科学研究所
4. 森山記念病院
5. 藤田医科大学 医学部生理学講座Ⅰ
6. 名古屋大学大学院医学系研究科 ウイルス学
7. 名古屋大学大学院医学系研究科 小児科学
8. 聖マリアンナ医科大学
9. 住友ファーマ株式会社 リサーチディビジョン
*(現:日本メジフィジックス株式会社)
1. 名古屋大学大学院医学系研究科 糖尿病・内分泌内科学
2. 住友ファーマ株式会社 再生・細胞医薬神戸センター
3. 住友化学株式会社 生物環境科学研究所
4. 森山記念病院
5. 藤田医科大学 医学部生理学講座Ⅰ
6. 名古屋大学大学院医学系研究科 ウイルス学
7. 名古屋大学大学院医学系研究科 小児科学
8. 聖マリアンナ医科大学
9. 住友ファーマ株式会社 リサーチディビジョン
*(現:日本メジフィジックス株式会社)
DOI
10.1016/j.stemcr.2023.05.002


