小児科学の伊藤哲哉教授らの研究成果が国際学術誌「Journal of Clinical Immunology」に掲載されました
本邦初の大規模な重症複合免疫不全症(SCID)に対する
TREC/KREC新生児マススクリーニング検査
~重症複合免疫不全症の新生児に対する早期診断と治療介入が予後を改善~
TREC/KREC新生児マススクリーニング検査
~重症複合免疫不全症の新生児に対する早期診断と治療介入が予後を改善~
本学医学部小児科学の伊藤 哲哉 教授、名古屋大学大学院医学系研究科 小児科学の高橋 義行 教授、村松 秀城 講師、若松 学 助教(筆頭著者)、愛知県健康づくり振興事業団健診事業部の酒井 好美 検査課長らの研究グループは、2017年から愛知県で出生した新生児に対して、全国に先駆けて重症複合免疫不全症(severe combined immunodeficiency; SCID)※1に対する新生児マススクリーニング検査を開始しました。2021年までに、約14万例にスクリーニング検査を行い、2例のSCID患者を診断し、造血細胞移植※2へとつなげることにより救命することができました。
SCIDは、さまざまな病原体から体を守るTリンパ球※3がうまく働かないため、新生児期から重篤な感染症を発症する最重症の原発性免疫不全症です。根治的な治療法である造血細胞移植を早期に行われなければ、生後1年以内に亡くなります。海外では、Tリンパ球が産生される際につくられるT-cell receptor excision circle(TREC)を用いた新生児マススクリーニング検査が広く行われていますが、本邦ではSCIDは未だ公的な新生児マススクリーニング検査の対象疾患に含まれていません。
また海外の一部の地域では、TREC測定に加えて、Bリンパ球※4が産生される際につくられるKappa-deleting recombination excision circle (KREC)の測定や網羅的遺伝子解析を組み合わせた新生児マススクリーニング検査が行われていますが、その有用性について十分に評価されていませんでした。
そこで我々は、2017年4月から2021年12月に愛知県内で出生した137,484例の新生児に対して、TRECとKRECを測定しました。結果、TRECもしくはKRECに異常値を145例に認め、精密検査として次世代シーケンサー(NGS)※5を用いた網羅的遺伝子解析を行い、SCID2例(68,742人に1人)(IL2RG-SCIDと細網異形成症)、TもしくはBリンパ球の欠損を伴うSCID以外の免疫不全症(non-SCID PIDs)10例(13,748人に1人)を診断しました。2例のSCIDは、診断後すみやかに感染予防を行い、適切な時期に造血細胞移植を行うことにより、救命することができました。
今回の取り組みは、本邦で初めて行われた大規模なSCIDに対する新生児マススクリーニング検査となります。網羅的遺伝子解析を組み合わせたTRECとKRECによる新生児マススクリーニング検査は、SCIDだけでなく、non-SCID PIDsの早期診断・治療につながり、臨床的にも非常に有用でした。この愛知県での取り組みが日本全国に広がり、将来的には公的な新生児マススクリーニング検査に組み込まれ、より多くのSCID患者の命が救われることが期待されます。
本研究成果は「Journal of Clinical Immunology」(2022年7月28日付電子版)に掲載されました。
発表のポイント
- 重症複合免疫不全症(SCID)は、生後早期に重篤な感染症を発症し、根治的な治療が行われないと生後1年以内に致命的となる免疫不全症です。
- 愛知県で出生した新生児を対象に、全国に先駆けて2017年からSCIDに対する新生児マススクリーニング検査を開始し、2021年までに約14万例のスクリーニング検査を行いました。これまでに、2例のSCIDが早期診断され、適切な時期に造血細胞移植を行うことで救命につながりました。
- 新生児マススクリーニング検査に網羅的遺伝子解析を組み合わせることで、SCIDだけでなく他の免疫不全症の新生児の診断にもつながりました。
背景
新生児マススクリーニングは、知らずに放置しておくと命にかかわるような疾患を、症状が出現する以前に見つけて予防する取り組みです。新生児期にスクリーニング検査を行うことで、対象となる疾患の患児を早期に診断し、治療介入を行い、健常な新生児と同じような生活を送ることができるようになります。重症複合免疫不全症(SCID)は、Tリンパ球がうまく機能しないために重篤な感染症を発症する原発性免疫不全症の一つです。根治的な治療法である造血細胞移植が適切な時期に行われない場合、生後1年以内に重篤な感染症により致死的な経過を辿ります。重篤な感染症を発症する以前にSCIDを診断・治療介入するための新生児マススクリーニング検査が、海外では広く行われています。米国のカリフォルニア州では、正常なTリンパ球が新たに作られるときにできるT-cell receptor excision circle(TREC)の測定を約300万人の新生児に対して実施し、およそ5万人あたり1人の新生児をSCIDと診断することができたと報告しています。日本ではこれまで公的な新生児マススクリーニング検査の対象疾患にSCIDは含まれておらず、家族例を有する症例以外は全例、重篤な感染症を発症したのちに診断され、治療成績は満足できるものではありませんでした。近年、次世代シーケンサー(NGS)を用いた網羅的遺伝子解析が、原発性免疫不全症の診断に有用であることが示されています。しかし、SCIDに対する新生児マススクリーニング検査陽性例に対する精密検査の一部として網羅的遺伝子解析を活用することについては、十分に評価されていません。また、海外のいくつかの国・地域からBリンパ球産生のマーカーであるKappa-deleting recombination excision circles (KREC)をTRECと同時に測定する取り組みが報告されているものの、KREC測定の偽陽性率の高さと費用の増加から、KRECの同時測定の是非は議論が分かれています。
そこで我々は、SCIDを生後早期に診断・治療介入するために、2017年4月から本邦で初めてTRECを用いたSCIDに対する新生児マススクリーニング検査を、愛知県内で出生した新生児を対象に、有料のオプショナルスクリーニング検査として開始しました。また、2020年4月からはTRECと同時にKRECの測定も行いました。期間中に、愛知県で出生した全新生児の約半数が、本スクリーニング検査を受けました(2021年では、54,891人中32,846人、 59.8 %)。スクリーニング陽性例は、精密検査としてリンパ球サブセット解析と免疫不全症に関する網羅的遺伝子解析を行いました。本スクリーニング検査は、名古屋大学大学院医学系研究科小児科学、藤田医科大学医学部小児科学、愛知県健康づくり振興事業団が協力して行いました。
研究成果
TRECおよび、KRECによる新生児マススクリーニング検査2017年4月から2020年3月に、TREC測定用キットを用い、80,791例の新生児に対してTRECの測定を行いました。80,791例の新生児のうち、TRECの異常値を認める新生児は112例(0.14%)でした。そのうち、79例に対して、免疫不全症に関連する網羅的遺伝子解析を行い、SCID以外の免疫不全症患者(non-SCID PIDs)を6例診断しました。内訳は、完全型DiGeorge症候群、10q11.22-q11.23微小欠失、8p逆位重複欠失症候群、軟骨毛髪低形成症、CHARGE症候群、Wiskott-Aldrich症候群を1例ずつ診断しました(図1A)。
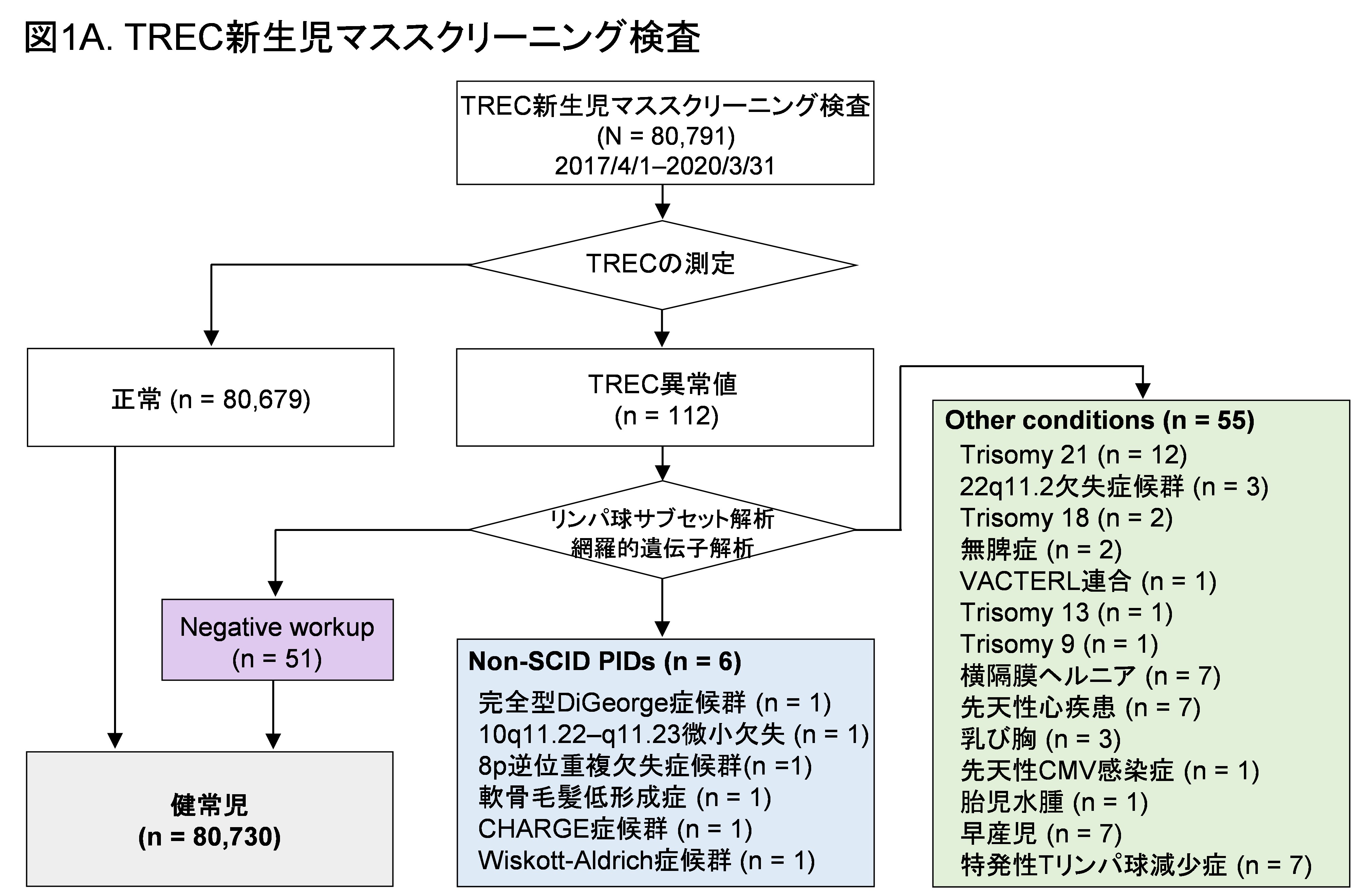
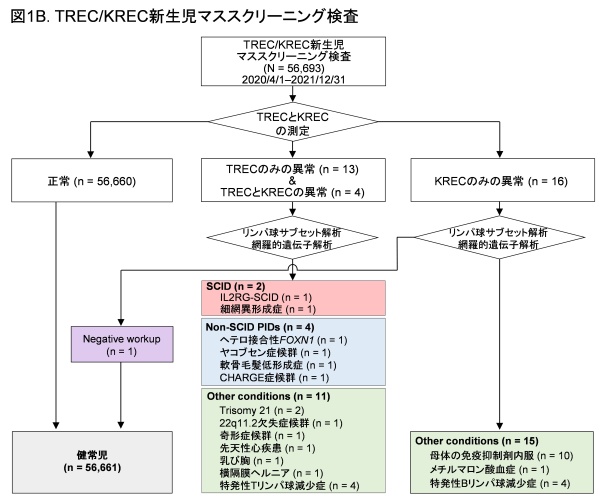
次に、2020年4月からTREC/KREC測定用キットに切り替えて、TRECと同時にKRECの測定を行い、Tリンパ球だけでなく、Bリンパ球も同時に評価しました。結果、2021年12月までに56,693例の新生児に対してTRECとKRECを測定し、33例(0.058%)でTRECもしくはKRECの異常値を認めました。このうち、TRECとKRECの両方が異常値4例、TRECのみ異常値13例、KRECのみ異常値16例が含まれました。スクリーニング陽性であった33例のうち、25例(76%)に免疫不全症に関連する網羅的遺伝子解析を行い、2例のSCID(IL2RG-SCIDと細網異形成症)、4例のnon-SCID PIDs(ヘテロ接合型FOXN1遺伝子変異に関連する胸腺低形成、軟骨毛髪低形成症、CHARGE症候群、およびヤコブセン症候群)を診断しました(図1B)。今回、KRECのみ異常値を認めた16例に、Bリンパ球のみに異常を認める免疫不全症と診断された患者はいませんでした。
SCID
137,484例の新生児のうち、2例(68,742人に1人)がSCID(IL2RG-SCIDと細網異形成症)と診断しました。一方、Tおよび/またはBリンパ球の欠損を伴う免疫不全症(non-SCID PIDs)として、10例(13,748人に1人)を診断しました。
IL2RG-SCIDの児は、生後4日で測定したTREC(1コピー/μL)が低値で名古屋大学医学部附属病院に紹介されました。リンパ球サブセット解析で、T-B+NK- SCIDの表現型を示し、ヘミ接合性IL2RG遺伝子変異を認め、IL2RG-SCIDと診断しました。患児は、生後4か月に臍帯血移植(CBT)※6を行い、ナイーブTリンパ球※7の増加を認めています。
細網異形成症の児は、生後4日で測定したTREC(0コピー/μL)、KREC(0コピー/μL)が低値で、生後6日目に同病院に紹介されました。リンパ球サブセット解析でT-B-NK- SCIDの表現型を示し、遺伝子解析にて複合ヘテロ接合型のAK2遺伝子変異を認め、細網異形成症と診断しました。患児は、生後半年でCBTを行い、好中球の生着に続いて、ナイーブTリンパ球の増加を認め、感染を認めることなく、元気に過ごされています。
TRECとTREC/KRECキットの性能比較
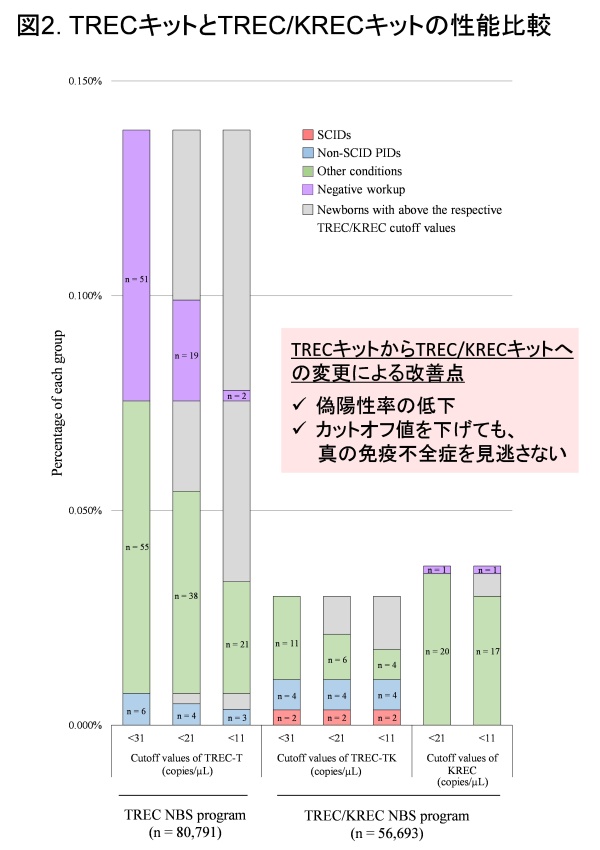
次に、2017年から使用したTRECキットと2020年から導入したTREC/KRECキットの性能を比較するために、2,841例の正常新生児、6例のnon-SCID PIDs、2例のSCIDの乾燥ろ紙血を用いて、両者のキットで測定したTREC値を検討しました。TREC/KRECキットで測定したTREC(TREC-TK)値は、TRECキットで測定したTREC(TREC-T)値と有意に相関を認め(P < 0.001)、特にTREC-TK値が低値の場合(<61 copies/μL)に強い相関関係を認めました。さらに、患者48例においてTREC-TとTREC-TK値は、CD4+CD45RA+ナイーブTリンパ球と中等度の相関を認めることを示しました。
最後に、それぞれのキットにおけるSCIDとnon-SCID PIDsに対する精密検査率と偽陽性率を比べました。TREC/KRECキット(TREC-TK)は、TRECキット(TREC-T)と比較して、精密検査率(0.138% [n = 112] vs. 0.058% [n = 33], P < 0.001) と偽陽性率(0.131% [n = 106] vs. 0.019% [n = 11], P < 0.001) がどちらも有意に低くなることを確認しました(図2)。
今後の展開
愛知県で大規模に開始したSCIDに対する新生児マススクリーニング検査を通じて、SCID新生児の早期診断に成功し、重篤な感染症に罹患することなく造血細胞移植へ繋げることができました。スクリーニング検査に網羅的遺伝子解析を組み合わせることで、non-SCID PIDsの診断にも貢献しました。全国に先駆けて、愛知県で開始したSCIDに対する新生児マススクリーニング検査は、国内の他の地域にも広がりつつあります。今後は、日本全国の新生児がこの新生児マススクリーニングの恩恵を受けられるように、公的マススクリーニングの対象疾患としてSCIDが一日も早く指定されることを期待しています。用語説明
※1 重症複合免疫不全症(SCID)
TまたはBリンパ球が欠損し、重篤な感染症を発症する原発性免疫不全症。※2 造血細胞移植
自分またはドナーから事前に採取した幹細胞を点滴で投与すること。※3 Tリンパ球
抗原を提示する細胞と連携し、免疫反応を調整するリンパ球。※4 Bリンパ球
抗原やTリンパ球を介した刺激により、抗体産生を行うリンパ球。※5 次世代シーケンサー(NGS)
数千から数百万ものDNA分子を同時に配列決定できる技術。※6 臍帯血移植(CBT)
臍帯血の造血幹細胞を移植し、造血機能を正常にする治療。※7 ナイーブTリンパ球
抗原にさらされたことのないTリンパ球。発表雑誌
掲雑誌名
Journal of Clinical Immunology論文タイトル
TREC/KREC Newborn Screening followed by Next-Generation Sequencing for Severe Combined Immunodeficiency in Japan著者
Manabu Wakamatsu, MD, PhD1, Daiei Kojima, MD, PhD2, Hideki Muramatsu, MD, PhD1, Yusuke Okuno, MD, PhD3, Shinsuke Kataoka, MD, PhD1, Fumiko Nakamura4, Yoshimi Sakai4, Ikuya Tsuge, MD, PhD5, Tsuyoshi Ito, MD6, Kazuto Ueda, MD7, Akiko Saito, MD, PhD7, Eiji Morihana, MD8, Yasuhiko Ito, MD9, Naoki Ohashi, MD, PhD10, Makito Tanaka, MD, PhD5, Taihei Tanaka, MD11, Seiji Kojima, MD, PhD1, Yoko Nakajima, MD, PhD5, Tetsuya Ito, MD, PhD5, and Yoshiyuki Takahashi, MD, PhD1所属名
1Department of Pediatrics, Nagoya University Graduate School of Medicine, Nagoya, Japan2Department of Pediatrics, Ogaki Municipal Hospital, Ogaki, Japan
3Department of Virology, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan
4Department of Clinical laboratory, Aichi Health Promotion Public Interest Foundation, Nagoya, Japan
5Department of Pediatrics, School of Medicine, Fujita Health University, Toyoake, Japan
6Department of Pediatrics Toyohashi Municipal Hospital, Toyohashi, Japan
7Division of Neonatology, Center for Maternal-Neonatal Care, Nagoya University Hospital, Nagoya, Japan
8Department of Neonatology, Aichi Children's Health and Medical Center, Obu, Japan
9Department of Pediatrics, Nagoya City University West Medical Center, Nagoya, Japan
10Department of Paediatric Cardiology, Chukyo Children Heart Centre, Japan. Community Health Care Organization Chukyo Hospital, Nagoya, Japan
11Department of Pediatrics, Japanese Red Cross Aichi Medical Center Nagoya Daini Hospital, Nagoya, Japan


