医学部情報生命科学の国田勝行講師らの研究成果が国際自然科学誌「Cell Reports」に掲載されました
細胞の変形・運動に複数のタンパク質が協調して関わる仕組みを数式で解明
複数の分子活性の経時変化を
同時測定データとして統合化するデータ解析手法を開発
~がんや免疫、神経疾患など医学生物学研究への応用が期待~
複数の分子活性の経時変化を
同時測定データとして統合化するデータ解析手法を開発
~がんや免疫、神経疾患など医学生物学研究への応用が期待~
藤田医科大学(愛知県豊明市)医学部 情報生命科学の国田 勝行講師(兼:精神・神経病態解明センター 計算科学部門)と奈良先端科学技術大学院大学(奈良県生駒市) データ駆動型サイエンス創造センターの作村 諭一教授(兼:先端科学技術研究科 バイオサイエンス領域 データ駆動型生物学研究室)、同大 先端科学技術研究科 情報科学領域の池田 和司教授、東京理科大学(千葉県野田市)の中村 岳史教授、自然科学研究機構 生命創成探究センター/基礎生物学研究所(愛知県岡崎市)の青木 一洋教授らの研究グループは、細胞の変形や移動の際に情報伝達の分子スイッチの役割を果たす3つのRhoファミリーGタンパク質※1(Rho GTPase)の活性度を細胞エッジ(周縁)の変形速度に定量的に変換する数式の導出に成功しました。
Rho GTPaseのうちCdc42、Rac1、RhoAの3つが細胞の形態制御に必要であることは知られていましたが、それぞれの役割を分担しながら協調して細胞を変形するという動的な制御メカニズムは未解明でした。本研究では、ヒト線維肉腫由来のHT-1080細胞※2において、これら3種の分子が細胞変形を説明するのに十分な情報を持っていることを数値的に証明すると共に、細胞変形に対してこれらの分子がどのように協調しているのかを解明しました。本研究で開発された解析法は、がん細胞や免疫細胞、発達中の神経細胞などのデータに応用可能で、医学や生物学の発展に寄与することが期待されます。本研究成果は、国際自然科学誌「Cell Reports(セル・リポーツ)」の2023年2月9日付(EST)オンライン版に掲載されました。
研究成果のポイント
- 複数の分子活性が協調して、細胞の変形・運動を制御する仕組みを定量的に表現する数式を導出しました。
- 生細胞イメージングで個別測定された複数の分子活性の経時変化を同時測定データとして統合化するデータ解析手法を開発しました。
- 3つのRho GTPase活性度とその時間微分の足し合わせによって、細胞エッジの変形速度が予測できることを数値的に実証しました。
背景
細胞内の分子はそれぞれが簡素な役割しか持ちませんが、複数の分子が協調することで細胞運動を含む高度な機能を実現します。Rho GTPaseのCdc42、Rac1、RhoAが細胞運動に「関係する」ことは、これまで多くの細胞生物学の研究で報告されてきました。しかし、これらの分子がどのように協調して細胞運動を制御するのか、その制御法はどのような数式で定量的に表現できるのかは未解明でした。その理由は、複数種のRho GTPaseの活性状態を同時に観測することの難しさにあります。生細胞でRho GTPaseの活性度を時系列として計測するには、近接した2つの蛍光分子間で生じる蛍光共鳴エネルギー移動(FRET)という発光現象の原理に基づくバイオセンサーを用いた生細胞イメージング(FRETイメージング※3)を使用します。一般的にFRETイメージングでは、各細胞で1種類の分子活性度を計測し、同一細胞で多種類の活性度を同時計測することは技術的な難しさを伴います。3つの分子と細胞形態変化が同時にどのように時間変化するか分からない以上、これらを定量的な数式で関係づけることも困難です。
本研究では、データサイエンス手法を導入することでこれらの問題を解決し、Cdc42、Rac1、RhoAの協調による細胞形態変化を決定付ける定量的な数式を構築し、3つの分子が細胞運動のキー分子であると示すことを目的としました。
研究手法・研究成果
研究グループは同時計測の問題を解決するデータ前処理法motion-triggered average(MTA)を開発しました。このMTAを用いて、個別の細胞で計測された3つのRho GTPaseの活性度時系列を擬似的に同時計測と見なせる時系列データに変換しました。Rho GTPaseの活性度を計測したイメージングデータから、ある細胞エッジにおける1種類のRho GTPase活性度とそのエッジの変形速度の時系列が得られます。また、どの細胞エッジも拡張と収縮の連続で変化します。したがって、短時間であればRho GTPaseの種類に関係なく類似したエッジ速度時系列をほとんどの細胞から見つけることが可能です。本研究では各Rho GTPaseごとにMTAを適用し、エッジが同じ動きをしたときの活性度時系列を収集し、データを平均化しました(図1)。これにより、エッジの特定の速度パターンと同時に発生した3つのRho GTPase活性度パターンを抽出できました。これらの活性度パターンは特定の速度パターンを生み出す最も典型的な時系列であり、擬似的に同時計測時系列と見なせます。抽出された3種の活性度時系列は、個々のRho GTPaseに関する先行研究の報告と一致する性質を持っており、細胞エッジの速度時系列に対してそれぞれの分子が固有の活性度時系列を持つことが分かりました。
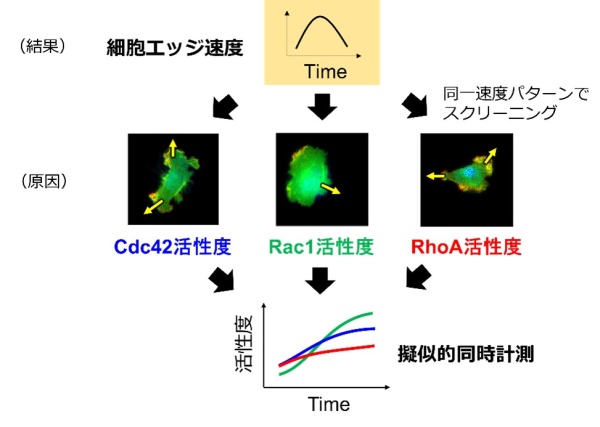
(図1)個別細胞で計測されたRho GTPase活性度を、同一の細胞の動きを基準に統合する。
得られた活性度時系列は擬似的に同時計測したデータとみなせる。
得られた活性度時系列は擬似的に同時計測したデータとみなせる。
次に、3種の活性度時系列を変換してエッジ速度系列を抽出する数式が得られるかどうか検証しました。3種の活性はいくつかの物理過程を経てエッジ変形に至ります。これらの過程をブラックボックスとして、活性度から速度への変換式が存在し得るかを調べました。定量的な変換式が存在すれば、活性度が変形速度の情報を持っていることを証明できます。
本研究では、5つのカテゴリーに分けられたエッジ速度時系列を用意し、それぞれに対応するRho GTPaseの活性度時系列をMTAにより抽出しました。モデル選択法※4や交差検証※5を用いた解析により、3つのRho GTPase活性度から定量的にエッジ速度を予測する数式が存在すること、それは活性度とその時間微分の和からなることが分かりました(図2)。ここで得られた数式はデータに潜む法則を捉えているといえるため、データ駆動の法則※6として他のあらゆる活性度パターンに対するエッジ速度予測も精度が良いと考えられます。本研究は初めて細胞内分子活性と細胞エッジ変形の関係を定量的に定式化しました。

(図2)MTAで得られたRho GTPase活性度からエッジ速度を予測する数式。
活性度とその微分の線形和となる。
今後の展開
本研究で得られた数式から、HT-1080細胞の移動方法の制御メカニズムが解明される可能性があります。MTAと数式フィッティングを他の細胞株に適用することで細胞種ごとの移動方法が解明され、メカニズムの違いから新たな生物学的発見が得られることが期待できます。またMTAのデータ前処理法は、原因と結果の時系列があれば、ヒトや植物、微生物など様々な生命現象に適用可能であり、複数の因子による制御システムの解明に役立ちます。用語解説
※1 RhoファミリーGタンパク質
細胞の移動や極性の制御に関わる主なシグナル分子。※2 HT-1080細胞
ヒト線維肉腫由来の細胞。変形と移動をするため、細胞運動の実験でよく利用される。※3 FRETイメージング
2つの蛍光タンパク質間で生じる蛍光エネルギー移動(FRET)の原理に基づき設計されたバイオセンサーを用いて、細胞内の分子活性度を計測するイメージング技術。タンパク質の活性やリン酸化など様々な分子活性の計測に用いられている。※4 モデル選択法
簡素なモデルで、かつ、実データとの誤差を少なくするようにしてモデルを選択する方法。赤池情報量基準など。※5 交差検証
データを学習データとテストデータに分割し、学習データで推定した数式のパラメータを用いて、テストデータの予測精度を評価する検証法。※6 データ駆動の法則
ケプラーの法則やメンデルの法則など。全てのデータでなくても、一部のデータで十分に検証された関係は、全てのデータでも成立すると考えられる。文献情報
論文タイトル
Decoding cellular deformation from pseudo-simultaneously observed Rho GTPase activities著者
国田 勝行1,2, 高木 敦弘3, 青木 一洋4,5,6, 池田 和司1,7,8, 中村 岳史9, 作村 諭一1,7所属
1. 奈良先端科学技術大学院大学 先端科学技術研究科2. 藤田医科大学 医学部
3. 愛知県立大学 情報科学部
4. 自然科学研究機構 基礎生物学研究所
5. 自然科学研究機構 生命創成探究センター(ExCELLS)
6. 総合研究大学院大学 生命科学研究科
7. 奈良先端科学技術大学院大学 データ駆動型サイエンス創造センター
8. 理化学研究所 革新知能統合研究センター (AIP)
9. 東京理科大学 生命医科学研究所


