複雑な縮環構造を持つヌクレオシド系抗生物質を新規開発
~薬剤耐性菌に対抗できる新しい抗生物質開発への貢献に期待~
ポイント
- 複雑な構造を持つ天然物誘導体の合成に成功。
- MraYとの複合体の構造解析と論理的薬物設計に成功。
- 薬剤耐性菌に対抗できる、新規抗菌薬開発の進展に期待。
概要
北海道大学大学院薬学研究院及び同大学国際連携研究教育局バイオサーフィス創薬グローバルステーションの市川 聡教授、山本一貴助教、勝山 彬助教、同大学大学院獣医学研究院の佐藤豊孝准教授、堀内基広教授、札幌医科大学の横田伸一教授、高橋 聡教授、藤田医科大学の港 雄介講師、及びデューク大学(アメリカ)のソクヨン・リー教授らの共同研究グループは、薬剤耐性菌に有効な新規ヌクレオシド系抗生物質の設計・合成・構造解析に成功しました。スファエリミシンという天然有機化合物は、MraYという酵素を強力に阻害することで抗菌活性を示します。研究グループは、二つの化学反応を鍵反応としてスファエリミシン誘導体を合成しました。次にMraYに結合したスファエリミシン誘導体の構造を決定したうえで、更に簡略化したスファエリミシン誘導体を論理的に設計しました。これらの誘導体は、薬剤耐性黄色ブドウ球菌やE. faeciumを含むグラム陽性菌に対して強力な抗菌活性を示すことがわかりました。本研究は、合成化学、創薬化学、構造生物学、微生物学を融合し、薬剤耐性菌に対する抗菌薬としてMraY阻害剤を開発するためのプラットフォームを提供するもので、薬剤耐性菌に対抗できる「最後の砦」となる抗生物質の開発が期待されます。
なお本研究成果は、日本時間2022年12月20日(火)午後7時公開のNature Communications誌に掲載される予定です。
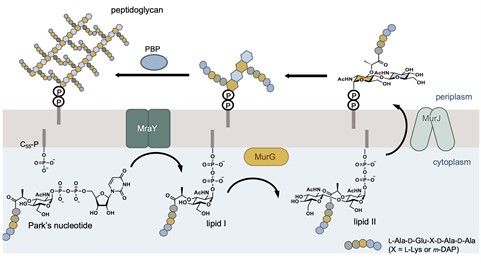
細菌細胞壁ペプチドグリカンの生合成の模式図
背景
細菌の抗菌薬耐性(AMR)は、人類の健康に深刻な脅威を与えています。近年の推定では、2019年には世界中で495万人がAMRに関連して死亡し、そのうち127万人がAMRに起因するとされています。AMRに対処するためには、新たな作用機序を持つ新規抗菌薬の開発が急務とされています。新しい抗菌薬の開発にはターゲットの選択が重要です。細菌の細胞壁であるペプチドグリカンの生合成は(p1図)、抗生物質を開発する上で良いターゲットとして知られ、これまでにペニシリンなどの-ラクタム系抗生物質やバンコマイシン等が開発されてきました。近年では、ペプチドグリカンの前駆体であるリピド I を合成する酵素MraY(すべての細菌の生育に必須な酵素)が、抗生物質開発の新たなターゲットとして期待されています。
スファエリミシン類は、Sphaerisporangium sp.SANK60911から単離されたヌクレオシド系の天然有機化合物で、強力なMraY阻害活性(IC50 13.9 nM)とグラム陽性菌に対する抗菌活性(MIC 1-16 μg/mL)を持つため、新規抗菌薬のリードとして期待されています。アミノリボースとピペリジン環が縮環した大環状構造を持つスファエリミシンは、最も複雑な化学構造を持つヌクレオシド天然有機化合物の一つです。ピペリジン環上の三つの置換基の絶対立体配置も決まっておらず、この縮環構造の合成は未達成でした。そのため、スファエリミシン類の創薬展開は進展していませんでした。
研究手法
本研究では、まず、ピペリジン環に関して考えられうる八つの立体異性体の中から、分子モデリングにより、簡略化したスファエリミシン誘導体であるSPM-1とSPM-2を設計しました(図1)。次に、鍵となる二つの反応を用いた化学変換を行うことで、SPM-1とSPM-2を合成しました(図2)。X線結晶構造解析により、SPM-1とMraY(高熱菌由来)が結合した状態の三次元構造を明らかにしました(図3)。更に、解析結果に基づき、より単純化したスファエリミシン誘導体の論理的設計と合成を行いました(図4)。研究成果
スファエリミシン類の縮環構造は、不斉辻-トロストアリルアルキル化反応とダブル還元アミノ化により構築しました(図2)。本方法は、この縮環構造の最初の合成例であり、ピペリジン環の他のジアステレオマーの合成に応用できる可能性があります。合成したSPM-1とSPM-2の生物活性を評価した結果、SPM-1がスファエリミシン類と同等のMraY阻害活性と抗菌活性を持つことがわかりました。次に、SPM-1とMraYの複合体の立体構造の解析(図3)から、SPM-1の縮環構造の立体化学がMraY阻害活性に重要だと判明しました。更に、得られた複合体構造に基づいた薬物設計を行うことで、より構造が単純で、合成も容易な誘導体であるSPM-3を合成しました(図4)。SPM-3は、SPM-1と同等の生物活性を保持し、メチシリン耐性黄色ブドウ球菌(MRSA)やバンコマイシン耐性腸球菌(VRE)などの薬剤耐性菌や、臨床的に分離された多剤耐性グラム陽性菌に対しても強力な抗菌活性を示しました(図5)。今後への期待
スファエリミシン類が有する縮環構造の配座は大きく制限されているため、この構造を足場として新たに導入する官能基の立体構造が予測しやすくなります。その結果、誘導体の設計が容易になります。今回、得られたMraYとの複合体構造とあわせて、より精密なMraY阻害剤の設計が可能となり、薬剤耐性菌に対抗できる「最後の砦」となる新規抗生物質の開発が期待されます。謝辞
本研究は、日本学術振興会(JSPS)科研費科学研究費補助金(B)(JP16H05097、JP19H03345、JP21H03622)、若手研究(B)(JP19K16648)、科学研究費補助金新学術領域研究「化学コミュニケーションのフロンティア」(JP18H04599, 20H04757)、国立研究開発法人日本医療研究開発機構(AMED)「BINDS」(JP22ama121039)等の一部の助成を受けて行われました。論文情報
論文名
Synthesis of macrocyclic nucleoside antibacterials and their interactions with MraY(大環状ヌクレオシド系抗菌薬の合成とそのMraYとの相互作用)著者名
Takeshi Nakaya,1 Miyuki Yabe,1 Ellene Mashalidis,2 Toyotaka Sato,3 Kazuki Yamamoto,4 Yuta Hikiji,1 Akira Katsuyama,4,5 Motoko Shinohara,6 Yusuke Minato,6 Satoshi Takahashi,7 Motohiro Horiuchi,3 Shin-ichi Yokota,7 Seok-Yong Lee,2 and Satoshi Ichikawa4,5所属
1北海道大学大学院生命科学院2デューク大学生化学部門
3北海道大学大学院獣医学研究院
4北海道大学大学院薬学研究院
5北海道大学国際連携研究教育局バイオサーフィス創薬グローバルステーション
6藤田医科大学
7札幌医科大学


