尋常性乾癬における好中球細胞外トラップの役割
藤田医科大学(愛知県豊明市沓掛町田楽ヶ窪1番地98)皮膚科学の杉浦一充教授、岩田洋平准教授、渡邊総一郎医師らの研究グループは、IL36RN遺伝子機能欠失変異に着目し、重度の乾癬様皮疹の解析を行いました。この結果、好中球細胞外トラップ (NETs) の形成に不可欠な、Peptidylarginine deiminase 4 (PAD4) という酵素を阻害することで、重度の乾癬様皮疹を抑制できることを明らかにしました。これらの成果により、NETsの形成は、Il36rn-/-マウスの重度の乾癬様皮疹の発症に関わっており、NETsはDITRA(インターロイキン36受容体アンタゴニストの欠損)の治療標的となる可能性が示唆されました。今後、NETs形成を抑制することで、DITRAに対する新規治療薬の開発が期待されます。
本研究成果は、Natureの学術ジャーナル「Scientific reports」で発表され、併せてオンライン版が2020年11月19日午前10時(UK time)に公開されました。
文献情報
本研究成果は、Natureの学術ジャーナル「Scientific reports」で発表され、併せてオンライン版が2020年11月19日午前10時(UK time)に公開されました。
研究成果のポイント
- Il36rn-/-マウスの背面に、イミキモド(IMQ)を3日間の連続塗布で、重度の乾癬様皮疹を引き起こした。
- NETs形成は、Il36rn-/-マウスの重度の乾癬様皮疹の発症に関わっており、NETsはDITRAの治療標的となる可能性を示唆した。
背景
当教室では、Il36rn-/-マウスを用いて、DITRAの研究を行ってきた。通常、インターロイキン36はインターロイキン36受容体と結合することで、NF-κBを介した炎症反応を起こす1.2)。一方、Il36rn遺伝子にコードされるインターロイキン36受容体アンタゴニスト(IL-36RA)は、インターロイキン36受容体に拮抗的に結合し炎症反応を抑制するが、DITRAではIL-36RAの機能が欠落しているため、炎症反応が増強する3−8)。従来、IMQをマウス背面に7日間塗布することで、乾癬様皮疹が誘発されるが、IL-36RAの機能欠損症では、乾癬様皮疹が増強することが知られている9.10)。尋常性乾癬では、リンパ球、樹状細胞、マクロファージの働きが明確になってきた11-15)。しかし、好中球やNETsの役割は徐々に解明されてきたものの16)、十分に解明されてはいない。当教室では、従来より簡便な方法として、Il36rn-/-マウスに、IMQを3日間外用することで、乾癬様皮疹を誘発することができた。この乾癬モデルマウスを用いて、重度の尋常性乾癬における好中球やNETsを中心とした病態を解明することで、新規治療薬の開発に到る可能性があり、臨床的に有意義であると考え、本研究を開始した。研究方法
- IL36RN遺伝子をノックアウトしたIl36rn-/-マウスとwild-typeマウスの背面の毛を除去し、3日間IMQを塗布し、4日目に、PASI (psoriasis and area severity index) スコア、病理学的検討や免疫組織学的手法を用いて乾癬様皮疹を評価した。
- Il36rn-/- マウスとwild-typeマウスの組織中のサイトカイン、ケモカインを評価するためにリアルタイムRT-PCRを行った。
- PAD4を阻害する効果を持つ、Cl-amidineをIl36rn-/- マウスに投与し、乾癬様皮疹に与える影響について検討した。
研究成果
- Il36rn-/- マウスでは、wild-typeマウスと比較して、乾癬様皮疹が有意に増強した。また、病理学的に、Il36rn-/-マウスでは、wild-typeマウスと比較し、表皮肥厚の程度、浸潤する好中球数、NETs形成の有意な増加を認めた (n=6, * p <0.05, ** p < 0.01)。
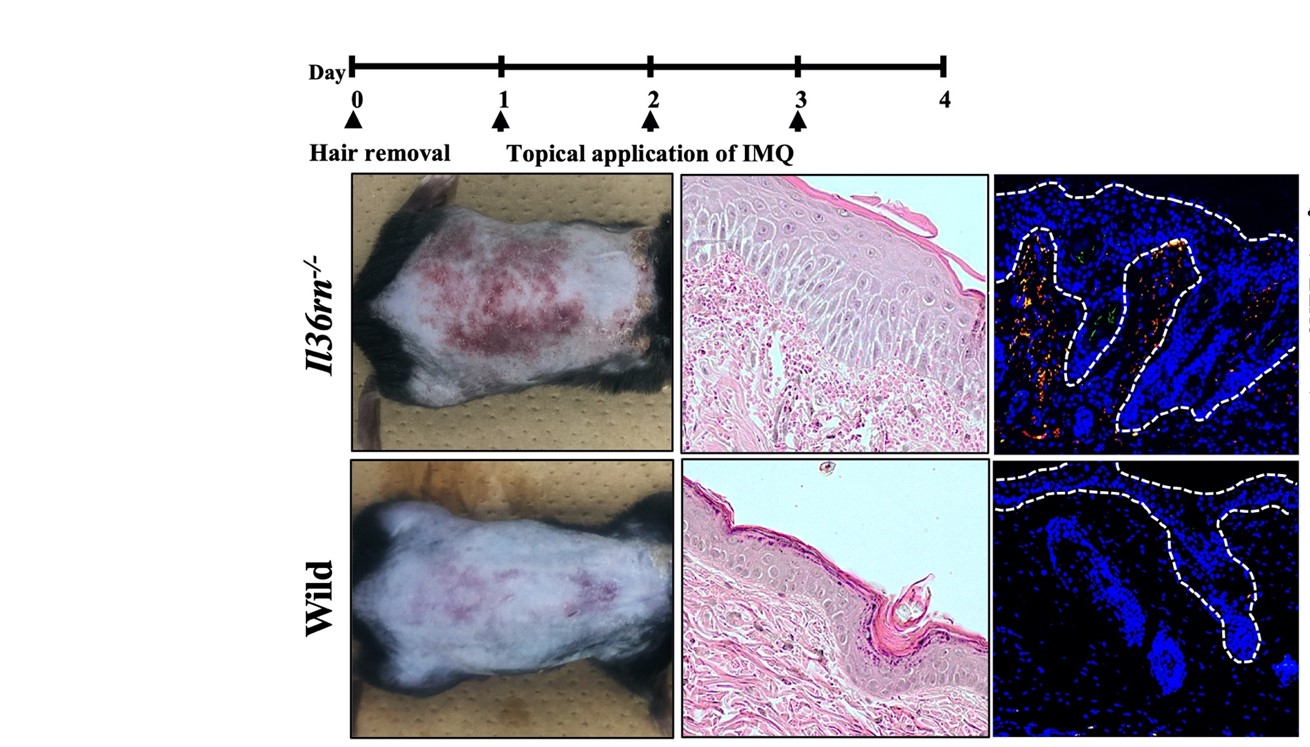
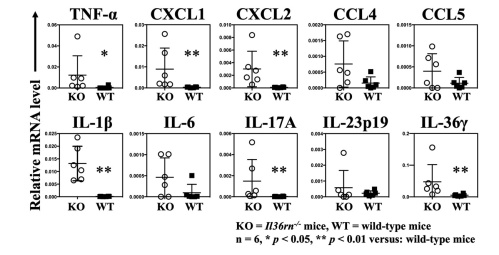
- 組織中のサイトカイン、ケモカインを評価したところ、Il36rn-/- マウスでは、wild-type マウスと比較して、TNF-α, CXCL1, CXCL2, IL-1β, IL-17A, および IL-36γの有意な増加を認めた。
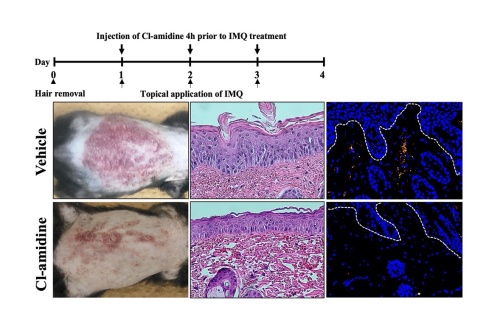
- Cl-amidineの投与により、Il36rn-/- マウスにおける乾癬様皮疹は抑制され、病理学的にも、表皮肥厚、浸潤する好中球数、NETs形成は抑制された。以上の結果から、Il36rn-/- マウスにおける乾癬様皮疹では、NETsが重要な役割を担っていることが示唆された。
今後の展開
IL-36Raの機能欠損症では、IL-36Rを介した持続的な炎症性シグナル伝達の活性化により、浸潤する好中球数は増加しNETs形成は促進される。その結果、Il36rn-/-マウスの重度の乾癬様病変が発症すると考えられる。したがって、NETsはDITRAにおいて新たな治療標的となる可能性がある。用語解説
- 好中球細胞外トラップ(Neutrophil extracellular traps, NETs):好中球が自らのDNAを細胞外に放出することでできる機構。DNA、ヒストン、好中球エラスターゼなどの細胞内抗菌蛋白を含む網目構造。
- Peptidylarginine deiminase 4 (PAD4):好中球において強く発現する核内タンパク質シトルリン化酵素。ヒストンH3をシトルリン化することでNETs形成を促す。
- イミキモド(imiquimod, IMQ):樹状細胞に存在するトール様受容体7(TLR7)に作用することで、NFκBを活性化し、TNF-αなど尋常性乾癬に関連するサイトカインを放出する。本邦では、性器・肛門周囲尖圭コンジローマや日光角化性の治療薬として承認されている。
文献情報
- Towne, J. E., Garka, K. E., Renshaw, B. R., Virca, G. D. & Sims, J. E. Interleukin (IL)-1F6, IL-1F8, and IL-1F9 signal through IL-1Rrp2 and IL-1RAcP to activate the pathway leading to NF-kappaB and MAPKs. J. Biol. Chem. 279, 13677-13688 (2004).
- Dinarello, C., et al. IL-1 family nomenclature. Nat. Immunol. 11, 1-3 (2010).
- Marrakchi, S., et al. Interleukin-36-receptor antagonist deficiency and generalized pustular psoriasis. N. Engl. J. Med. 365, 620-628 (2011).
- Onoufriadis, A., et al. Mutations in IL36RN/IL1F5 are associated with the severe episodic inflammatory skin disease known as generalized pustular psoriasis. Am. J. Hum. Genet. 89, 432-437 (2011).
- Sugiura, K., et al. The majority of generalized pustular psoriasis without psoriasis vulgaris is caused by deficiency of interleukin-36 receptor antagonist. J. Invest. Dermatol. 133, 2514-2521 (2013).
- Sugiura, K. The genetic background of generalized pustular psoriasis: IL36RN mutations and CARD14 gain-of-function variants. J. Dermatol. Sci. 74, 187-192 (2014).
- Akiyama, M., Takeichi, T., McGrath, J. A. & Sugiura, K. Autoinflammatory keratinization diseases: An emerging concept encompassing various inflammatory keratinization disorders of the skin. J. Dermatol. Sci. 90, 105-111 (2018).
- Akiyama, M., Takeichi, T., McGrath, J. A. & Sugiura, K. Autoinflammatory keratinization diseases. J. Allergy Clin. Immunol. 140, 1545-1547 (2017).
- Palomo, J., Troccaz, S., Talabot-Aye, D., Rodriguez, E., & Palmer, G. The severity of imiquimod-induced mouse skin inflammation is independent of endogenous IL-38 expression. PLoS ONE. 13, 1-15 (2018).
- Tortola, L., et al. Psoriasiform dermatitis is driven by IL-36–mediated DC-keratinocyte crosstalk. J Clin Invest. 122, 3965-3976 (2012).
- Bagchi, S., et al. CD1b-autoreactive T cells contribute to hyperlipidemia-induced skin inflammation in mice. J Clin Invest. 127, 2339-2352 (2017).
- Di Meglio P., Villanova, F., Navarini, AA., Mylonas, A., & Tosi, I., et al. Targeting CD8(+) T cells prevents psoriasis development. J Allergy Clin Immunol. 13, 274-276 (2016).
- Kirby, B., Langerhans cells in psoriasis: getting to the core of the disease. Br J Dermatol. 178, 1240 (2018).
- Wang, H., et al. Activated macrophages are essential in a murine model for T cell-mediated chronic psoriasiform skin inflammation. J Clin Invest. 116, 2105-2114 (2006).
- Boehncke, W. H., & Schön, M. P., Psoriasis. Lancet. 386, 983-994 (2015).
- Shao, S., et al. Neutrophil extracellular traps promote inflammatory responses in psoriasis via activating epidermal TLR4/IL-36R crosstalk. Front Immunol. 10, 1-14 (2019).


